题目内容
15.下列说法中正确的是( )| A. | C2H6与C4H10一定互为同系物 | |
| B. | C2H4与C4H8一定互为同系物 | |
| C. | 分子量相同的两种物质一定互为同分异构体 | |
| D. | 分子中含有羟基的物质一定是醇 |
分析 A.结构相似、分子组成相差若干个“CH2”原子团的有机化合物互相称为同系物;
B.C2H4为乙烯,C4H8可能为丁烯,也有可能是环丁烷;
C.具有相同分子式而结构不同的化合物互为同分异构体;
D.分子中含有羟基的化合物不一定是醇.
解答 解:A.C2H6与C4H10结构相似、分子组成相差2个“CH2”原子团,故互为同系物,故A正确;
B.C2H4为乙烯,C4H8可能为丁烯,也有可能是环丁烷,故不一定互为同系物,故B错误;
C.相对分子质量相同的不同物质,不一定具有相同的分子式,如乙醇与甲酸,所以不一定互为同分异构体,故C错误;
D.分子中含有羟基的化合物也可能是酚类,如苯酚中-OH与苯环直接相连,故D错误;
故选A.
点评 本题考查同系物的判断、同分异构体的特点、有机物的组成等知识,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
5.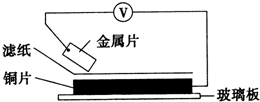 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( )
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( )
 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( )
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( ) | 金属 | 电子流动方向 | 电压(V) |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | -0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | E→Cu | +0.30 |
| A. | 金属乙能从硫酸铜溶液中置换出铜 | |
| B. | 甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀 | |
| C. | 在四种金属中乙的还原性最强 | |
| D. | 甲、丁若形成原电池时,甲为正极 |
6.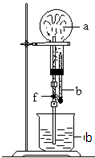 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )| a(干燥气体) | b(液体) | |
| ① | N02 | 水 |
| ② | CO2 | 4mol•L-1NaOH溶液 |
| ③ | C12 | 饱和食盐水 |
| ④ | NH3 | l mol•L-1盐酸 |
| A. | ①和② | B. | ③和④ | C. | ①和③ | D. | ②和④ |
3.下列微粒与Na+具有相同的质子数和电子数的是( )
| A. | Ne | B. | NH4+ | C. | F- | D. | H2O |
10.下表为元素周期表的一部分,列出了7种元素在元素周期表中的位置:
请按要求回答下列问题(用化学用语回答):
(1)写出③的原子结构示意图: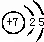 ,③与①所形成的化合物的结构式为:
,③与①所形成的化合物的结构式为: .
.
(2)7种元素中,原子半径最小的是:H.
(3)用电子式表示元素②与④最高价化合物的形成过程: .
.
(4)元素⑤和元素⑥最高价氧化物的水化物碱性由强到弱关系为:NaOH>Al(OH)3.
(5)元素④的氢化物与元素⑦的单质反应的离子方程式为:Cl2+H2O=H++Cl-+HClO.
(6)用一个化学方程式证明④的单质的活泼性强于③的单质:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
(1)写出③的原子结构示意图:
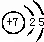 ,③与①所形成的化合物的结构式为:
,③与①所形成的化合物的结构式为: .
.(2)7种元素中,原子半径最小的是:H.
(3)用电子式表示元素②与④最高价化合物的形成过程:
 .
.(4)元素⑤和元素⑥最高价氧化物的水化物碱性由强到弱关系为:NaOH>Al(OH)3.
(5)元素④的氢化物与元素⑦的单质反应的离子方程式为:Cl2+H2O=H++Cl-+HClO.
(6)用一个化学方程式证明④的单质的活泼性强于③的单质:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
20.饱和烃A和不饱和烃B在常温下均为气体(碳原子数不大于4),其中A分子中含有碳原子数多于B.
(1)将A和B按一定比例混合.1L混合气体完全燃烧后在同温、同压下得到3.6LCO2.试推断该混合气体的可能组合及A与B混合时的体积比.将结果填入下表.
(2)120℃时,1LA、1LB与足量氧气混合点燃后,在同温、同压下总体积增大2L.试通过计算确定A和B的分子式.
(1)将A和B按一定比例混合.1L混合气体完全燃烧后在同温、同压下得到3.6LCO2.试推断该混合气体的可能组合及A与B混合时的体积比.将结果填入下表.
| 编号 | A的分子式 | B的分子式 | VA:VB |
| ① | C4H10 | C3H6 | 3:2 |
| ② | C4H10 | C2H4 | 4:1 |
| ③ | C4H10 | C2H2 | 4:1 |
| ④ | C4H10 | C3H4 | 3:2 |
4.下列说法中,正确的是( )
| A. | IA和VIIA族元素间可形成共价化合物 | |
| B. | 第二周期:从左到右最高价从+1到+7 | |
| C. | 同主族的单核阴离子:还原性越强,离子半径越小 | |
| D. | 同周期金属:原子失电子能力越强,最高化合价越高 |
5.A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
(1)写出A、B、C三种元素名称:氮、硫、氟.
(2)B位于周期表中第三周期第ⅥA族.
(3)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
| A | C | |
| B |
(2)B位于周期表中第三周期第ⅥA族.
(3)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.