题目内容
11.用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示,下列说法正确的是( )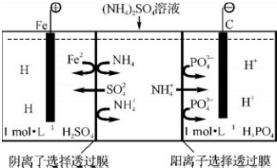
| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 阴极的电极反应式为:4OH--4e═2H2O+O2↑ | |
| C. | 电解一段时间后,阴极室溶液中的pH升高 | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
分析 A.根据图片知,Fe为阳极,阳极上Fe 2+失电子发生氧化反应;
B.阴极上H+放电生成H2;
C.电解时,阴极上H+放电生成H2,溶液中c(OH-)增大;
D.电解时,溶液中NH4+向阴极室移动,H+放电生成H2,溶液中的溶质为NH3.H2O和(NH4)3PO4或NH4HPO4、(NH4)2HPO4.
解答 解:A.根据图片知,Fe为阳极,阳极上Fe 2+失电子发生氧化反应生成Fe 3+,电极反应式为Fe 2+-e-=Fe3+,所以溶液由浅绿色变为棕黄色,故A错误;
B.阴极上H+放电生成H2,电极反应式为2H2O+4e-═2OH-+H2↑,故B错误;
C.电解时,阴极上H+放电生成H2,溶液中c(OH-)增大,溶液中pH增大,故C正确;
D.电解时,溶液中NH4+向阴极室移动,H+放电生成H2,溶液中OH-和NH4+结合生成电解质NH3.H2O,所以阴极室中溶质为NH3.H2O和(NH4)3PO4或NH4HPO4、(NH4)2HPO4,故D错误;
故选C.
点评 本题考查电解原理,明确阴阳极上发生的电极反应是解本题关键,会正确书写电极反应式,知道电解后溶液中溶质成分,题目难度不大.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
1.下列有关实验的叙述合理的是( )
| A. | 可用瓷坩埚灼烧氢氧化钠固体 | |
| B. | 中和热测定实验中可用铜制搅拌棒代替玻璃环形搅拌棒 | |
| C. | 用酸式滴定管量取12.00mL高锰酸钾溶液 | |
| D. | 用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小 |
19.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol C(金刚石)中含有C-C键的数目为4NA | |
| B. | 标准状况下,22.4L乙烯中含有σ键的数目为5NA | |
| C. | 含0.2moi H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目为0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极得到电子的数目为NA |
16. 25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )
25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )
 25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )
25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )| A. | 可用酚酞作该滴定的指示剂 | |
| B. | 当溶液中c(H+)+c(OH-)=2×10-7时,c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 当滴定到pH=4.75时,c(A-)>c(Na+)>c(HA) | |
| D. | 当滴入40mL NaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
5.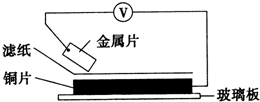 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( )
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( )
 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( )
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( ) | 金属 | 电子流动方向 | 电压(V) |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | -0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | E→Cu | +0.30 |
| A. | 金属乙能从硫酸铜溶液中置换出铜 | |
| B. | 甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀 | |
| C. | 在四种金属中乙的还原性最强 | |
| D. | 甲、丁若形成原电池时,甲为正极 |
3.下列微粒与Na+具有相同的质子数和电子数的是( )
| A. | Ne | B. | NH4+ | C. | F- | D. | H2O |
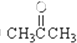 ③CH3CH2Br④
③CH3CH2Br④ ⑤
⑤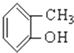 ⑥
⑥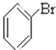 ⑦
⑦ ⑧
⑧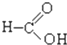 ⑨
⑨ ⑩
⑩