题目内容
14.下列离子方程式中正确的是( )| A. | 稀醋酸与NaOH溶液的反应:H++OH-═H2O | |
| B. | 铜粉与稀硝酸的反应:Cu+2H+═Cu2++H2↑ | |
| C. | 氯气与碘化钾溶液的反应:Cl2+I-═Cl-+I2 | |
| D. | 碳酸钠溶液与足量稀盐酸的反应:CO32-+2H+═CO2↑+H2O |
分析 A.醋酸为弱电解质,保留化学式;
B.不符合反应的客观事实;
C.原子个数不守恒;
D.碳酸钠溶液与足量稀盐酸的反应生成二氧化碳和水.
解答 解:A.稀醋酸与NaOH溶液的反应,离子方程式:CH3COOH+OH-═H2O+CH3COO-,故A错误;
B.铜粉与稀硝酸的反应生成硝酸铜、一氧化氮和水:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O,故B错误;
C.氯气与碘化钾溶液的反应,离子方程式:Cl2+2I-═2Cl-+I2,故C错误;
D.碳酸钠溶液与足量稀盐酸的反应,离子方程式:CO32-+2H+═CO2↑+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确离子方程式书写的方法及化学反应的实质是解题关键,注意化学式的拆分及原子个数守恒,题目难度不大.

练习册系列答案
相关题目
5.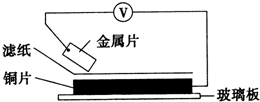 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( )
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( )
 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( )
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( ) | 金属 | 电子流动方向 | 电压(V) |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | -0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | E→Cu | +0.30 |
| A. | 金属乙能从硫酸铜溶液中置换出铜 | |
| B. | 甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀 | |
| C. | 在四种金属中乙的还原性最强 | |
| D. | 甲、丁若形成原电池时,甲为正极 |
9.A、B、C三种强电解质,它们在水中电离出的离子如表所示:
如图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极接通电源,经过一段时间后,测得乙中C电极质量增加了27克.常温下各烧杯中溶液的pH与电解时间t的关系如图2.
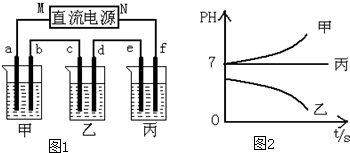
据此回答下列问题:
(1)M为电源的负极(填写“正”或“负”),甲、乙电解质分别为NaCl、AgNO3(填写化学式).
(2)计算电极f上生成的气体在标准状况下的体积:1.4L.
(3)写出乙烧杯的电解池总反应方程式:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3.
(4)要使丙恢复到原来的状态,应加入2.25克(填质量)的H2O.(填写化学式)
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |

据此回答下列问题:
(1)M为电源的负极(填写“正”或“负”),甲、乙电解质分别为NaCl、AgNO3(填写化学式).
(2)计算电极f上生成的气体在标准状况下的体积:1.4L.
(3)写出乙烧杯的电解池总反应方程式:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3.
(4)要使丙恢复到原来的状态,应加入2.25克(填质量)的H2O.(填写化学式)
19.下列变化过程需加入氧化剂的是( )
| A. | HCl→H2 | B. | Mg→Mg2+ | C. | Cl-→AgCl | D. | CuO→Cu |
6.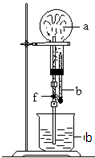 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )| a(干燥气体) | b(液体) | |
| ① | N02 | 水 |
| ② | CO2 | 4mol•L-1NaOH溶液 |
| ③ | C12 | 饱和食盐水 |
| ④ | NH3 | l mol•L-1盐酸 |
| A. | ①和② | B. | ③和④ | C. | ①和③ | D. | ②和④ |
3.下列微粒与Na+具有相同的质子数和电子数的是( )
| A. | Ne | B. | NH4+ | C. | F- | D. | H2O |
4.下列说法中,正确的是( )
| A. | IA和VIIA族元素间可形成共价化合物 | |
| B. | 第二周期:从左到右最高价从+1到+7 | |
| C. | 同主族的单核阴离子:还原性越强,离子半径越小 | |
| D. | 同周期金属:原子失电子能力越强,最高化合价越高 |
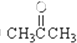 ③CH3CH2Br④
③CH3CH2Br④ ⑤
⑤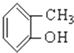 ⑥
⑥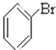 ⑦
⑦ ⑧
⑧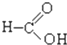 ⑨
⑨ ⑩
⑩