题目内容
12.从化学键角度分析,下列属于化学变化的是( )| A. | 蔗糖溶解 | B. | H2SO4溶于水 | C. | NH3溶于水 | D. | 氯化镁受热熔化 |
分析 既有旧化学键断裂,又有新化学键形成的变化是化学变化,以此分析.
解答 解:A.蔗糖属于非电解质,溶于水没有化学键的断裂,故A错误;
B.H2SO4溶于水属于物理过程,只存在旧键的断裂,没有新键生成,故B错误;
C.NH3溶于水反应生成一水合氨发生了化学变化,既有旧化学键断裂,又有新化学键形成,故C正确;
D.氯化镁晶体受热熔化属于物理过程,只存在旧键的断裂,没有新键生成,故D错误.
故选C.
点评 本题考查化学键知识,题目难度不大,注意化学变化与物理变化,化学键的断裂和形成的区别,注意分子间作用力和化学键的区别.

练习册系列答案
相关题目
3.下列微粒与Na+具有相同的质子数和电子数的是( )
| A. | Ne | B. | NH4+ | C. | F- | D. | H2O |
20.饱和烃A和不饱和烃B在常温下均为气体(碳原子数不大于4),其中A分子中含有碳原子数多于B.
(1)将A和B按一定比例混合.1L混合气体完全燃烧后在同温、同压下得到3.6LCO2.试推断该混合气体的可能组合及A与B混合时的体积比.将结果填入下表.
(2)120℃时,1LA、1LB与足量氧气混合点燃后,在同温、同压下总体积增大2L.试通过计算确定A和B的分子式.
(1)将A和B按一定比例混合.1L混合气体完全燃烧后在同温、同压下得到3.6LCO2.试推断该混合气体的可能组合及A与B混合时的体积比.将结果填入下表.
| 编号 | A的分子式 | B的分子式 | VA:VB |
| ① | C4H10 | C3H6 | 3:2 |
| ② | C4H10 | C2H4 | 4:1 |
| ③ | C4H10 | C2H2 | 4:1 |
| ④ | C4H10 | C3H4 | 3:2 |
17.常温时,下列各组离子能大量共存的是( )
| A. | Ag+、K+、NO3-、Cl- | B. | Fe3+、NH4+、SO42-、NO3- | ||
| C. | Fe2+、Na+、Cl-、ClO- | D. | H+、I-、SO42-、HCO3- |
4.下列说法中,正确的是( )
| A. | IA和VIIA族元素间可形成共价化合物 | |
| B. | 第二周期:从左到右最高价从+1到+7 | |
| C. | 同主族的单核阴离子:还原性越强,离子半径越小 | |
| D. | 同周期金属:原子失电子能力越强,最高化合价越高 |
1.氯化钠是日常生活中人们常用的调味品.是下列事实中,可以证明NaCl中一定存在离子键的是( )
| A. | 水溶液能导电 | B. | 易溶于水 | C. | 熔化时能导电 | D. | 有较高的熔点 |
2.已知自然界氧的核素有16O、8O,氢的核素有 H、D,从水分子的原子组成来看,自然界的水一共有( )
| A. | 3种 | B. | 6种 | C. | 9种 | D. | 12种 |
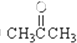 ③CH3CH2Br④
③CH3CH2Br④ ⑤
⑤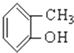 ⑥
⑥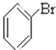 ⑦
⑦ ⑧
⑧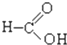 ⑨
⑨ ⑩
⑩