题目内容
【题目】请按要求回答问题。
(1)Si的基态原子核外电子排布式____,S的基态原子核外有____个未成对电子
(2)用“<”“>”填空
离子半径 | 电负性 | 熔点 | 酸性 |
O2-____Na+ | N___O | 金刚石_____晶体硅 | 硫酸___高氯酸 |
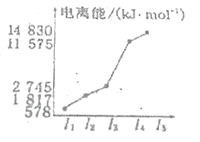
(3)第三周期某元素的电离能情况如图所示,则该元素位于元素周期表第____列
(4)Mn、Fe均为第4周期的过渡元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是______。
(5)下图能表示HF分子形成的是(____)
a.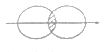 b.
b.![]()
c.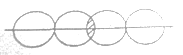 d.
d.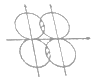
【答案】1s22s22p63s23p2 2 > < > < 13 Mn2+的价电子排布式为3d5,原子轨道处于半满状态,能量低更稳定,而Fe2+的价电子排布式为3d6,3d能级有6个电子,失去一个电子就达到3d5半充满稳定结构,故Fe2+容易再失去一个电子 b
【解析】
(1)Si是14号元素,其基态原子核外电子排布式1s22s22p63s23p2,S为16号元素,其基态原子核外电子排布式1s22s22p63s23p4,有2个未成对电子;答案:1s22s22p63s23p2;2。
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+;同周期自左而右,元素电负性增大,所以电负性N<O;金刚石与晶体硅均属于原子晶体,C原子半径较小,键长更短,故C-C键更稳定,熔沸点金刚石>晶体硅;非金属性S<Cl,非金属性越强,最高价含氧酸的酸性越强,故酸性:H2SO4<HClO4,因此,本题正确答案是:>;<;>;<。
(3)由图表可知该元素的各级电离能逐级增大,I1和I2、I3差别较小,但I4I3,I4突跃式变大,即失去3个电子后,再失去电子变为+4价阳离子非常困难,该元素的核外电子排布为1s22s22p63s23p1,说明该元素为第IIIA主族,在元素周期表的第13列。答案:13。
(4)原子轨道处于半满、全满、全空时,能量更低、更稳定,Mn2+的价电子排布式为3d5,3d能级有5个电子,为半充满状态,能量低更稳定,所以难再失去一个电子,而Fe2+的价电子排布式为3d6,3d能级有6个电子,失去一个电子就达到3d5半充满稳定结构,故Fe2+容易再失去一个电子。答案:Mn2+的价电子排布式为3d5,原子轨道处于半满状态,能量低更稳定,而Fe2+的价电子排布式为3d6,3d能级有6个电子,失去一个电子就达到3d5半充满稳定结构,故Fe2+容易再失去一个电子。
(5)HF是双原子分子,两个原子共用一对电子形成共价键,键角为180![]() ,因为F的电负性很大,容易形成氢键,氟原子和另外一个分子中的氢原子形成氢键,所以b符合题意;答案:b。
,因为F的电负性很大,容易形成氢键,氟原子和另外一个分子中的氢原子形成氢键,所以b符合题意;答案:b。

 名校课堂系列答案
名校课堂系列答案