题目内容
【题目】Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备CuO。
(1)Cu2+基态核外电子排布式为________。
(2)SO42-的空间构型为_______(用文字描述)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为______;推测抗坏血酸在水中的溶解性:_______(填“难溶于水”或“易溶于水”)。
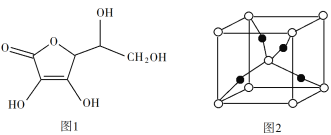
(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为_________。
【答案】1s22s22p63s23p63d9 正四面体 sp3、sp2 易溶于水 4
【解析】
(1)Cu元素原子核外电子数为29,其基态原子的电子排布式为1s22s22p63s23p63d104s1,Cu原子失去4s、3d能级的1个电子形成Cu2+;
(2)计算硫酸根离子硫原子价层电子对数和孤电子对数,依据价层电子对互斥理论判断空间构形;
(3)该分子中亚甲基、次亚甲基上C原子价层电子对个数都是4,连接碳碳双键和碳氧双键的C原子价层电子对个数是3,根据价层电子对互斥理论判断该分子中碳原子的轨道杂化类型;抗坏血酸中羟基属于亲水基,增大其水解性;
(4)依据均摊法计算黑球与白球个数,依据化学式Cu2O判断。
(1)Cu元素原子核外电子数为29,其基态原子的电子排布式为1s22s22p63s23p63d104s1,Cu原子失去4s、3d能级的1个电子形成Cu2+,Cu2+的核外电子排布式为:1s22s22p63s23p63d9;
(2)SO42-的中心S原子的价电子层电子对数为![]() =4,含有的孤电子对数为:
=4,含有的孤电子对数为:![]() =0,依据价电子互斥理论可知为正四面体构型;
=0,依据价电子互斥理论可知为正四面体构型;
(3)该分子中亚甲基、次亚甲基上C原子价层电子对个数都是4,连接碳碳双键和碳氧双键的C原子价层电子对个数是3,根据价层电子对互斥理论判断该分子中碳原子的轨道杂化类型,前者为sp3杂化、后者为sp2杂化;
抗坏血酸分子中存在羟基,羟基属于亲水基,增大其水解性,所以抗坏血酸易溶于水;
(4)该晶胞中白色球个数=8×![]() +1=2,黑色球个数为4,则白色球和黑色球个数之比=2:4=1:2,根据其化学式知,白色球表示O原子、黑色球表示Cu原子,则该晶胞中Cu原子数目为4。
+1=2,黑色球个数为4,则白色球和黑色球个数之比=2:4=1:2,根据其化学式知,白色球表示O原子、黑色球表示Cu原子,则该晶胞中Cu原子数目为4。

【题目】请按要求回答问题。
(1)Si的基态原子核外电子排布式____,S的基态原子核外有____个未成对电子
(2)用“<”“>”填空
离子半径 | 电负性 | 熔点 | 酸性 |
O2-____Na+ | N___O | 金刚石_____晶体硅 | 硫酸___高氯酸 |
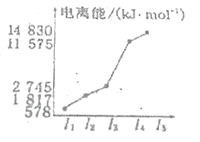
(3)第三周期某元素的电离能情况如图所示,则该元素位于元素周期表第____列
(4)Mn、Fe均为第4周期的过渡元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是______。
(5)下图能表示HF分子形成的是(____)
a.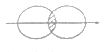 b.
b.![]()
c.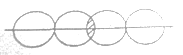 d.
d.