题目内容
【题目】实验室用63%的浓HNO3(其密度为1.4g/mL)配制240mL0.50mol/L稀HNO3,若实验仪器有:A.10mL量筒 B.50mL量筒 C.托盘天平 D.玻璃棒 E.100mL容量瓶 F.250mL容量瓶 G.500mL容量瓶 H.胶头滴管 I.200mL烧杯。
(1)此浓硝酸的物质的量浓度为___mol/L。
(2)应量取63%的浓硝酸___mL,应选用的量筒是___(填仪器的字母编号)。
(3)实验时还需选用的仪器有(填序号)D、I、___(填序号)
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是___(填序号)。
①量取浓硝酸的量筒用蒸馏水洗涤2﹣3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③定容时俯视刻度线
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
【答案】14.0 8.9 A F、H ①③
【解析】
(1)由![]() 可得:63%的浓HNO3(其密度为1.4g/mL)的物质的量浓度
可得:63%的浓HNO3(其密度为1.4g/mL)的物质的量浓度![]() /L=14.0mol/L,故答案为:14.0;
/L=14.0mol/L,故答案为:14.0;
(2)由于无240mL容量瓶,故应选用250mL容量瓶,配制出250mL溶液,浓硝酸稀释前后溶质的物质的量不变,有c(浓)×V(浓)=c(稀)×V(稀)得:V(浓)=![]() ≈8.9mL,应选用10mL量筒量取,故答案为:8.9;A;
≈8.9mL,应选用10mL量筒量取,故答案为:8.9;A;
(3)据配制步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有10mL量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管,故还需要的仪器有250mL容量瓶和胶头滴管,即F、H,故答案为:F、H;
(4)①量取浓硝酸的量筒用蒸馏水洗涤23次,并把洗涤液转入容量瓶,会导致溶质的量偏多,则浓度偏高,①正确;
②容量瓶使用时未干燥,对浓度无影响,②错误;
③定容时俯视刻度线,导致溶液体积偏小,浓度偏高,③正确;
④定容时不小心有少量蒸馏水滴到瓶外,无影响,④错误;
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线是正常的,再加蒸馏水补至刻度线会导致溶液体积偏大,浓度偏低,⑤错误;
故答案为:①③。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】请按要求回答问题。
(1)Si的基态原子核外电子排布式____,S的基态原子核外有____个未成对电子
(2)用“<”“>”填空
离子半径 | 电负性 | 熔点 | 酸性 |
O2-____Na+ | N___O | 金刚石_____晶体硅 | 硫酸___高氯酸 |
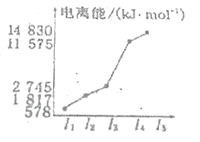
(3)第三周期某元素的电离能情况如图所示,则该元素位于元素周期表第____列
(4)Mn、Fe均为第4周期的过渡元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是______。
(5)下图能表示HF分子形成的是(____)
a.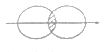 b.
b.![]()
c.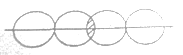 d.
d.