题目内容
【题目】请按要求完成下列各题:
(1)将一小块钠投入到盛CuSO4溶液的烧杯中,剧烈反应,放出气体并生成蓝色沉淀,其反应的离子方程式为___。
(2)将FeSO4溶液与过量NaOH溶液混合并在空气中放置一段时间,整个过程中的现象为___,反应过程分两步,其中第2步反应的化学方程式为___。
(3)写出溶液中硫酸氢钠的电离方程式___。
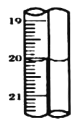
(4)配制某浓度的稀硫酸,用10mL量筒量取浓硫酸的体积如图Ⅰ所示,A与B,B与C刻度间相差1mL,如果刻度A为8,量筒中浓硫酸的体积是___mL。

(5)要用CuSO4·5H2O晶体配制500mL0.01mol/LCuSO4溶液,应该用托盘天平称取CuSO4·5H2O___g(读到小数点后两位)
(6)图Ⅱ所示仪器的名称是___。
【答案】2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑ 生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 NaHSO4=Na++H++SO42- 7.2 1.25 500mL容量瓶
【解析】
(1)将一小块钠投入到盛CuSO4溶液的烧杯中,钠与水反应生成氢气和氢氧化钠,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀,总离子方程式为2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑;
(2)将FeSO4溶液与过量NaOH溶液混合并在空气中放置一段时间,先生成氢氧化亚铁沉淀,氢氧化亚铁被氧气氧化成红褐色氢氧化铁沉淀,所以可以观察到:生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色;第二步反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)硫酸氢钠在水溶液中完全电离,方程式为NaHSO4=Na++H++SO42-;
(4)量筒小刻度在下,A与B与C刻度间相差1mL,刻度A为8,则刻度B为7,AB间每一小格为0.2mL,则量筒中液体的体积为7.2mL;
(5)配制500mL0.01mol/LCuSO4溶液,需要CuSO45H2O的物质的量为0.01mol/L×0.5L=0.005mol,质量为0.005×250g/mol=1.25g。
(6)图Ⅱ所示仪器的名称500mL容量瓶。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案【题目】在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________(填“吸热”或“放热”)反应,理由是__________。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应向_____(填“正向”或“逆向”)进行。
【题目】请按要求回答问题。
(1)Si的基态原子核外电子排布式____,S的基态原子核外有____个未成对电子
(2)用“<”“>”填空
离子半径 | 电负性 | 熔点 | 酸性 |
O2-____Na+ | N___O | 金刚石_____晶体硅 | 硫酸___高氯酸 |
(3)第三周期某元素的电离能情况如图所示,则该元素位于元素周期表第____列
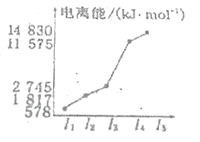
(4)Mn、Fe均为第4周期的过渡元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是______。
(5)下图能表示HF分子形成的是(____)
a. b.
b.![]()
c. d.
d.