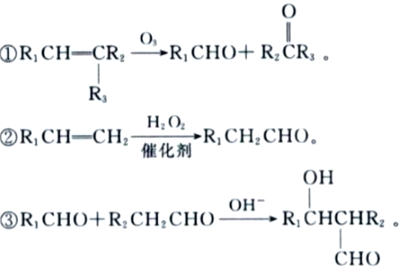
题目内容
【题目】分析图,甲、乙具有的共性是
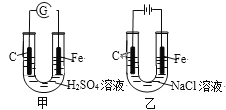
A. 反应物能量均高于生成物能量
B. 电极反应均有Fe-2e→Fe2+
C. 碳棒上均发生氧化反应
D. 溶液pH均增大
【答案】D
【解析】
甲装置是原电池,Fe失去电子、发生氧化反应,电极反应式为Fe-2e-=Fe2+,C电极上发生还原反应、电极反应式为2H++2e-=H2↑;乙装置是电解池,C电极为阳极、发生氧化反应,电极反应式为2Cl--2e-=Cl2↑,Fe电极为阴极、反应还原反应,电极反应式为2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑),
A.Fe和硫酸发生的置换反应是放热反应,即反应物能量均高于生成物能量,而电解食盐水需要消耗电能,是吸热反应,即反应物能量低于生成物能量,故A错误;
B.甲装置发生Fe-2e-=Fe2+的电极反应,乙装置Fe为阴极,不会发生Fe-2e-=Fe2+的电极反应,电极反应式为2H2O+2e-=H2↑+2OH-,故B错误;
C.甲装置中碳棒上H+得到电子、发生还原反应,乙装置碳棒上Cl-失去电子、发生氧化反应,故C错误;
D.甲装置消耗H+、酸性减弱、pH增大,乙装置生成NaOH、碱性增强、pH增大,故D正确;
故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目