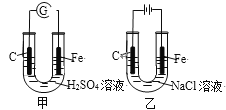
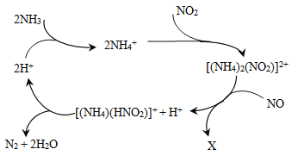
题目内容
【题目】聚合氯化铝晶体([Al2(OH)nCl(6-n)XH2O]m)是一种高效无机水处理剂。它的制备原理是调节AlCl3溶液的pH,通过促进其水解而结晶析出。
回答下列问题:
(1)铝原子核外能量最高的电子有_____个。分析AlCl3熔点较低的原因(熔点:AlCl3—194℃,Al2O3—2054℃,NaCl—801℃)。____________________________________________________
(2)比较聚合氯化铝晶体中同周期两种元素的原子半径,并用原子结构知识说明理由。___________
(3)铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)可制备AlCl3,如果先除去铝灰中的金属氧化物杂质可选用__________(选填:“强碱”或“强酸”)。写出其中Al发生反应的离子方程式_______________________________。
(4)制备聚合氯化铝晶体,需严格控制溶液的pH在4.0~4.5才能使产率达到最大。结合AlCl3水解的离子方程式,用化学平衡移动原理解释控制pH在4.0~4.5之间的原因_______________________________
【答案】1 AlCl3是分子晶体,分子间以较弱的分子间作用力结合 Al>Cl;Al和Cl原子核外电子层数相同,Al比Cl的核电荷数小,核对外层电子的吸引力也小,所以半径也小 强碱 2OH-+2Al+2H2O→2AlO2-+3H2↑ Al3++3H2O![]() Al(OH)3+3H+;pH太小,氯化铝的水解平衡向左移动,产率减小;pH太大则水解平衡向右移动,生成氢氧化铝沉淀,产率也会下降
Al(OH)3+3H+;pH太小,氯化铝的水解平衡向左移动,产率减小;pH太大则水解平衡向右移动,生成氢氧化铝沉淀,产率也会下降
【解析】
(1)根据Al原子的核外电子排布1s22s22p63s23p1可得;AlCl3是分子晶体,熔沸点低;
(2)聚合氯化铝晶体中同周期两种元素的原子为Al和Cl,电子层数均为3,核外电子数不同,原子核对核外电子的吸引力不同;
(3)铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)可制备AlCl3,只有Al、Al2O3溶于强碱生成偏铝酸盐,与金属氧化物杂质分离,再将偏铝酸盐用盐酸酸化得AlCl3;
(4)AlCl3水解的离子方程式为Al3++3H2O![]() Al(OH)3+3H+,根据酸碱性对平衡的影响分析。
Al(OH)3+3H+,根据酸碱性对平衡的影响分析。
(1)Al核电荷数为13,具有3个电子层,最外层电子数为3,核外电子排布式为:1s22s22p63s23p1,3p为能量最高的轨道,只有一个电子;AlCl3是分子晶体,分子间作用力较弱,故AlCl3熔点较低;
(2)聚合氯化铝晶体中同周期两种元素的原子为Al和Cl,Al和Cl原子核外电子层数相同,Al比Cl的核电荷数小,核对外层电子的吸引力也小,所以半径也小,故Al>Cl;
(3)铝灰中只有Al、Al2O3溶于强碱生成偏铝酸盐,与金属氧化物杂质分离,发生的反应为:2OH-+2Al+2H2O→2AlO2-+3H2↑;
(4)AlCl3水解的离子方程式为:Al3++3H2O![]() Al(OH)3+3H+,pH太小,氯化铝的水解平衡向左移动,产率减小,pH太大则水解平衡向右移动,生成氢氧化铝沉淀,产率也会下降,故需需严格控制溶液的pH;
Al(OH)3+3H+,pH太小,氯化铝的水解平衡向左移动,产率减小,pH太大则水解平衡向右移动,生成氢氧化铝沉淀,产率也会下降,故需需严格控制溶液的pH;

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】烟气(主要污染物SO2、NOX)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中的SO2、NOx 的含量。
(1) O3氧化烟气中SO2、NOx 的主要反应的热化学方程式为: NO(g)+O3(g)![]() NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)
NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)![]() 3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)
3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)![]() 2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
(2)T℃时,利用测压法在刚性反应器中,投入一定量的NO2发生反应3NO2(g)![]() 3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
①若降低反应温度,则平衡后体系压强 p______24.00 MPa(填“>”、“<”或“=”),原因是____________。
②15min 时,反应物的转化率 α=______。
③T℃时反应3NO2(g)![]() 3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
(3)T℃时,在体积为2L的密闭刚性容器中,投入2 mol NO2发生反应2NO2(g)![]() 2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):
2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):

①在体积不变的刚性容器中,投入固定量的NO2发生反应,要提高NO2转化率,可采取的措施是______________、___________。
②由图中数据,求出该反应的平衡常数为_________。
③计算A 点处v正/v逆=_________________________(保留1位小数)。