题目内容
【题目】推断题
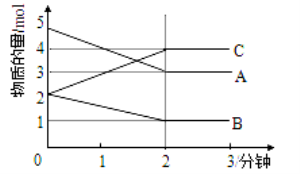
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:

(1)写出下列元素名称:A B C D E F .
(2)写出元素C的离子结构示意图____________。
(3)D、E、F的简单离子半径由大到小的顺序是 。
(4)B与C形成的化合物,既含有离子键又含有非极性键,该化合物的电子式为_______________。
(5)A、C、E三种元素形成的具有漂白性的化合物,该化合物的结构式为 。
(6)D与E形成的化合物的类别是________________(填共价化合物或离子化合物)。
(7)能证明C的非金属性比F强的实验事实是 。
【答案】(1)氢 钠 氧 铝 氯 硫(2)![]() (3)S2->Cl->Al3+(4)
(3)S2->Cl->Al3+(4)![]()
(5)H-O-Cl(6)共价化合物(7)水比硫化氢稳定
【解析】试题分析:(1)A的单质是密度最小的物质,故A是氢元素;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,且B是短周期元素,所以B是钠元素;C的原子最外层电子数是其内层电子数的三倍,且C是短周期元素,所以C是氧元素;D与B同周期,该周期中D的简单离子半径最小,故D是铝元素;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,消毒剂
的主要成分是次氯酸钠,所以E是氯元素;F元素最高正价与最低负价的代数和为4,且F是短周期元 素,所以F是硫元素;
(2)据(1)分析,氧离子的结构示意图是![]() 。
。
(3)铝离子的电子层数小于硫离子、氯离子的电子层数,电子层数越多,离子半径越大,所以铝离子半径小于氯离子和硫离子半径;电子层数相同的离子,离子半径随着原子序数的增大而减小,所以硫离 子半径大于氯离子半径,则为S2->Cl->Al3+。
(4)B与C形成的化合物,既含有离子键又含有非极性键,是过氧化钠,电子式为:![]() 。
。
(5)A、C、E三种元素形成的具有漂白性的化合物是次氯酸,该化合物的结构式为H-O-Cl。
(6)D与E形成的化合物是氯化铝,类别是共价化合物。
(7)非金属性强弱可用氢化物稳定性判断。

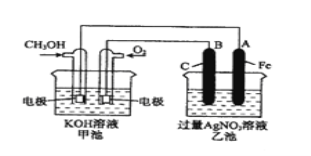
【题目】【化学–选修2:化学与技术】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
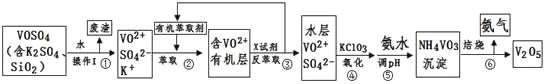
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4 (水层)
2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 。
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有 和 。