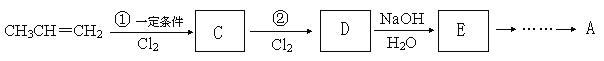
��Ŀ����
����Ŀ������ѧ�Cѡ��2����ѧ�뼼������ҵ����ƽ�VOSO4�е�K2SO4��SiO2���ʳ�ȥ�����յõ�V2O5���������£�
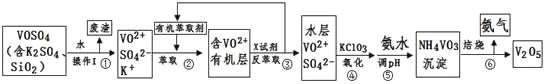
��ش��������⣺
��1�����������÷����ijɷ��� ��д��ѧʽ��������I������ ��
��2�������������ı仯���̿ɼ�Ϊ����ʽR��ʾVO2+��HA��ʾ�л���ȡ������
R2(SO4)n(ˮ��)��2nHA���л��㣩![]() 2RAn���л��㣩��nH2SO4 (ˮ��)
2RAn���л��㣩��nH2SO4 (ˮ��)
������ȡʱ��������������ԭ���� ��
����X�Լ�Ϊ ��
��3���������ӷ���ʽΪ ��
��4��25��ʱ��ȡ����������������õ��������ʺ���ҺpH֮���ϵ���±���
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
��������% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
����ϱ�����ʵ�������У����м��백ˮ��������Һ�����pHΪ ��
����������Ϊ93.1%ʱ������Fe(OH)3����������Һ��c(Fe3+)�� ��
����֪��25��ʱ��Ksp[Fe(OH)3]��2.6��10��39��
��5���ù��������У�����ѭ�����õ������� �� ��
���𰸡���1��SiO2��1�֣� ���ˣ�2�֣� ��2��������к����ᣬ��ʹƽ�������ƶ�����߷�����ȡ�ʣۻ����Ʊ����������RAn���л��㣩��Ũ�ȡ��ٷֺ����ȣݣ�2�֣� H2SO4��2�֣�
��3��6VO2+��ClO3����9H2O==6VO3����Cl����18H+��2�֣�
��4��1.7��1.8����1.7��1.8����һ������2�֣���2.6��10��3mol��L��1��2�֣�
��5����������ˮ����1�֣����л���ȡ����1�֣�
�������������������1�������ܽ��������費����ˮ����˹��˵õ���������Ҫ�ɷ�Ϊ�������裻
��2��������ȡʱ����������������ƽ��R2(SO4)n(ˮ��)��2nHA���л��㣩![]() 2RAn���л��㣩��nH2SO4 (ˮ��)��֪������ļ���ƽ���е������ӷ�Ӧ�ٽ�ƽ��������У�
2RAn���л��㣩��nH2SO4 (ˮ��)��֪������ļ���ƽ���е������ӷ�Ӧ�ٽ�ƽ��������У�
���з���ȡʱ�����X�Լ�������ƽ��������У����Լ�����������ƽ��������У�
��3�����������������������VO2+����Ӧ����Ԫ�ػ��ϼ۴ӣ�5�۽��͵���1�ۣ��õ�6�����ӡ�VԪ�ػ��ϼۣ�4�����ߵ���5�ۣ�ʧȥ1�����ӣ����ݵ��ӵ�ʧ�غ��ԭ���غ��֪��Ӧ�����ӷ���ʽΪ6VO2+��ClO3����9H2O==6VO3����Cl����18H+��
��4�����ݱ��������жϣ����м��백ˮ��������ҺpH���ֵΪ1.7��1.8����ʱ�������ʴﵽ�����Ҫ��ˮ����С������������Ϊ93.1%ʱ������Fe��OH��3��������ʱpH=2��c��H+��=0.01mol/L��c��OH-��=10-12mol/L������Һ��c��Fe3+��Ũ�������ܶȻ����㣬��Ksp[Fe��OH��3]=c��Fe3+����c3��OH-��=2.6��10-39�����c��Fe3+��=2.6��10-3molL-1��������Fe��OH��3����������Һ��c��Fe3+����2.6��10-3molL-1��
��5����������ͼ�����ʲμӷ�Ӧ����Ӧ�����������ɵ����ʣ��ظ����õ����ʿ���ѭ�����ã��������л���ȡ������������ѭ�����á�