题目内容
【题目】I.“低碳经济”时代,科学家利用“组合转化”等技术对CO2进行综合利用。
(1) CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g) △H=akJ·mol-1已知:H2(g)的燃烧热为285.8kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0kJ·mol-1,H2O(g)=H2O(l)
CH2=CH2(g)+4H2O(g) △H=akJ·mol-1已知:H2(g)的燃烧热为285.8kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0kJ·mol-1,H2O(g)=H2O(l)
△H=-44.0kJ·mol-1,则a=______kJ·mol-1。
(2)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如图,下列有关说法不正确的是_______(填序号)

①温度越高,催化剂的催化效率越高
②温度低于250℃时,随着温度升高,乙烯的产率增大
③M点平衡常数比N点平衡常数大
④N点正反应速率一定大于M点正反应速率
⑤增大压强可提高乙烯的体积分数
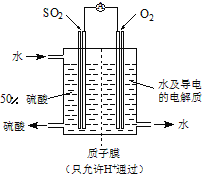
(3)2012年科学家根据光合作用原理研制出“人造树叶”。右图是“人造树叶”的电化学模拟实验装置图,该装置能将H2O和CO2转化为O2和有机物C3H8O。

阴极的电极反应式为::_________________________
II.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
(4)上述反应使用等质量的某种催化剂时,温度和催化剂的比表面积对化学反应速率的影响对比实验如下表,c(NO)浓度随时间(t)变化曲线如下图:


①表中a=___________。
②实验说明,该反应是__________反应(填“放热”或“吸热”)。
③若在500℃时,投料=1,NO的转化率为80%,则此温度时的平衡常数K=_____。
(5)使用电化学法也可处理NO的污染,装置如右图。已知电解池阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:__________。吸收池中除去NO的离子方程式为:__________________。

【答案】(1)-127.8
(2)①②④)
(3)3CO2+18H++18e-=C3H8O+5H2O
(4)①1.20×10-3②放热(只写“放”不给分)③主要有三种情况,书写正确的均给2分。
第一种情况:设c(NO)=1mol·L-1,则K=160
第二种情况:设c(NO)=a mol·L-1,则K=
第三种情况:设n(NO)=a mol,容器的容积为VL,,则K=
(5)2HSO3-+2H++2e-=S2O42-+2H2O 2NO+2S2O42-+2H2O=N2+4HSO3-
【解析】
试题分析:
(1)①6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)△H=a kJ/mol,
CH2=CH2(g)+4H2O(g)△H=a kJ/mol,
②H2O (g)=H2O(1) △H==-571.6 kJ/mol,
因为H2和CH2=CH2的燃烧热分别为285.8kJ/mol和1411kJ/mol,即
③2H2(g)+O2(g)=2H2O(l)△H=- 44 kJ/mol,
④CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H= -1411 kJ/mol
根据盖斯定律:③×3-④-②×4=①,则a=3×(-571.6 kJ/mol)-(-1411 kJ/mol)-4×(- 44 kJ/mol) =-127.8kJ/mol,故答案为:-127.8;
(2)该反应为气体系数减小的放热反应。①温度太高,催化剂会失去催化活性,效率降低,错误;②温度低于250℃时,随温度升高乙烯的产率减小,错误;③由于该反应是放热反应,升温平衡逆向移动,则平衡常数:KM>KN,正确;④生成乙烯的速率既受温度影响,也受催化剂影响,N点温度高但催化剂催化效率低,M点温度低但催化剂催化效率高,所以M点正反应速率有可能大于N点正反应速率,错误;⑤增大压强,平衡正向移动,可提高乙烯的体积分数,正确。故答案为:①②④;
(3)该装置能将H2O和CO2转化为O2和有机物C3H8O,根据化合价可知,CO2转化为C3H8O化合价降低,发生还原反应,根据图示可知与电源负极连接的电极为阴极,电极的反应式为:3CO2+ 18H++18e-= C3H8O+5H2O;
(4)①因研究的是温度和催化剂的比表面积对化学反应速率的影响。根据控制变量法可知,NO的初始浓度应该一样,即a=1.20×10-3,b=82;
②根据曲线Ⅰ和Ⅲ可知,温度越高,NO的平衡浓度越大,反应逆向移动,则正反应为放热反应。
③根据平衡常数表达式可知:K= ,投料=1,NO的转化率为80%,
设c(NO)=1mol·L-1,则转化了的NO为0.8mol·L-1,平衡体系中NO、CO、CO2、N2浓度分别为0.2mol·L-1、0.2mol·L-1、0.8mol·L-1、0.4mol·L-1,代入表达式可得K=160;
同理可设c(NO)=a mol·L-1,则K=;
也可设n(NO)=a mol,容器的容积为VL,则K=;
(5)由题给装置图知电解池的阴极区HSO3-得电子发生还原反应生成S2O42-,电解质溶液呈酸性,阴极的电极反应式:2HSO3-+2e-+2H+==S2O42-+2H2O。吸收池中NO与S2O42-反应生成氮气和HSO3-,离子方程式为:2NO+2S2O42-+2H2O==N2+ 4HSO3-。

 综合自测系列答案
综合自测系列答案【题目】实验室制备环己酮的反应原理:

其反应的装置示意图如下(夹持装置、加热装置略去):

环己醇、环己酮、饱和食盐水和水的部分物理性质见下表(注:括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点)
物质 | 沸点(℃) | 密度(g·cm-3, 20℃) | 溶解性 |
环己醇 | 161.1(97.8) | 0.962 | 能溶于水 |
环己酮 | 155.6(95) | 0.948 | 微溶于水 |
饱和食盐水 | 108.0 | 1.330 | |
水 | 100.0 | 0.998 |
(1)实验中通过装置B将酸性Na2Cr2O7溶液加到盛有环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
① 仪器B的名称是 。
② 蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是 。
③ 蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151~ 156℃馏分,得到精品
b.过滤
c.在收集到的粗品中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水
① 上述操作的正确顺序是 (填序号)。
② 在上述操作c中,加入NaCl固体的作用是 。

(3)环己酮是一种常用的萃取剂,以环己酮为成分之一的萃取液对金属离子的萃取率与pH的关系如上图。现有某钴矿石的盐酸浸出液, 浸出液含有的阳离子主要有H+、Co2+、Mn2+、Al3+,除去Al3+ 后,再利用萃取法分离出MnCl2以得到较为纯净的CoCl2溶液,pH范围控制在 。
a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(4)在实验中原料用量:20mL环己醇、酸性Na2Cr2O7溶液10mL,最终称得产品质量为14.7g,则所得环己酮的产率为 (百分数精确到0.1)。
(5)实验产生的含铬废液易污染环境,可将Cr2O72-转化为Cr3+,再转化为Cr(OH)3沉淀除去,为使Cr3+浓度小于1×10-5mol/L,应调节溶液的pH=___________。(已知该条件下Cr(OH)3的Ksp是6.4×10-31, lg2=0.3 lg5=0.7)