题目内容
6.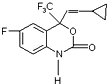 M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )
M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )| A. | 该物质易溶于水 | |
| B. | M能发生缩聚反应 | |
| C. | M分子内至少有15个原子在同一个平面上 | |
| D. | M的分子式为C13H22O2NF4 |
分析 A.该物质中憎水基基团较大,影响物质的溶解性程度较大;
B.含有醛基、酯基、F原子、苯环、碳碳双键,具有胺、酯、卤代烃、苯和烯烃性质;
C.苯环上的所有原子及连接苯环的碳原子能共面;
D.根据结构简式确定分子式.
解答 解:A.该物质中憎水基基团较大,影响物质的溶解性程度较大,所以该物质不易溶于水,故A错误;
B.含有醛基、酯基、F原子、苯环、碳碳双键,具有胺、酯、卤代烃、苯和烯烃性质,不能发生缩聚反应,故B错误;
C.苯苯环及所连原子共平面,N原子所连原子共平面,碳碳双键所连原子共平面,所以该分子中至少有15个原子共面,故C正确;
D.根据结构简式确定分子式为C14H11O2NF4,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,难点是判断分子式及原子共面,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列有关元素周期表中的某些推断正确的是( )
| A. | 位于同一主族的元素的价电子数相同,则各元素的常见化合价也一定相同 | |
| B. | 碱金属族元素同卤族元素一样,其单质的熔沸点随元素原子序数的增大而逐渐升高 | |
| C. | 若x是ⅡB族中元素的原子序数,那么原子序数为x+1的元素是ⅢA族 | |
| D. | 在周期表中金属和非金属元素的分界线附近的元素是过渡元素 |
14.化学键是( )
| A. | 只存在于分子之间 | |
| B. | 是相邻的两个或多个原子或离子之间强烈的相互作用 | |
| C. | 只存在于离子之间 | |
| D. | 是相邻的两个或多个离子之间强烈的静电作用 |
1.下列事实不能用勒夏特列原理解释的是( )
| A. | 增大压强能缩短碘化氢分解反应达到平衡的时间 | |
| B. | 配制硫酸铁溶液时,向溶液中加入少量硫酸 | |
| C. | 往醋酸溶液中加碱溶液,使c(CH3COO-) 增大 | |
| D. | 向水中加入酸可抑制水的电离 |
15.某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
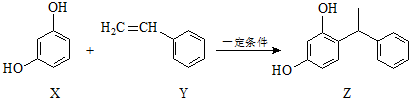
下列叙述错误的是( )

下列叙述错误的是( )
| A. | X、Y和Z均能使溴水褪色 | |
| B. | X和Z均能与NaHCO3溶液反应放出CO2 | |
| C. | 上述反应X+Y→Z属于加成反应 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
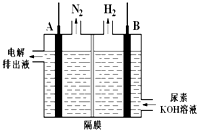
16.氮元素的化合物种类繁多,性质也各不相同
(1)已知
①N2(g)+2O2(g)═N2O4(g)△H=+10.7KJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-624KJ/mol
写出气态肼和N2O4反应生成氮气和液态水的热化学方程式:2H2N4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1258.7kJ/mol
(2)一定温度下,在密闭容器中可逆反应:2NO2(g)?N2O4(g)△H<0,下列叙述正确的是AC
A.单位时间内生成1molN2O4的同时生成2molNO2,达到平衡状态
B.达到平衡后,其它条件不变,升高温度,容器内气体颜色变浅
C.置于绝热的恒容容器中,容器中气体颜色不变时,说明达到平衡状态
D.加入适当的催化剂,NO2的转化率可以增大
(3)在100℃时,将0.400mol的NO2气体充入2L的容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
①反应开始直至10min时,N2O4的平均反应速率为:0.0025mol/L•min
②升高温度后,平衡常数K将减低(填“增高”、“减低”或“不变”)
③若在相同情况下向该容器中只充入N2O4气体,要达到上述同样的平衡状态,N2O4的起始物质的量是0.200mol
(4)亚硝酸钠(NaNO2)是一种常见的食品添加剂,具有防腐和增色作用
①亚硝酸钠中氮元素的化合价为+3,由此推断其可能C.(填字母序号)
A.只有氧化性 B.只有还原性 C.既有氧化性,也有还原性
②已知亚硝酸属于弱酸,则NaNO2溶液显碱性;(填“酸性”、“中性”或“碱性”)原因是NO-+H2O?HNO2+OH-.(用离子方程式表示)
(5)肼-空气燃烧电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,放电时生成N2和水,则放电时负极电极反应式为N2H4-e-+4OH-=N2↑+4H2O.
(1)已知
①N2(g)+2O2(g)═N2O4(g)△H=+10.7KJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-624KJ/mol
写出气态肼和N2O4反应生成氮气和液态水的热化学方程式:2H2N4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1258.7kJ/mol
(2)一定温度下,在密闭容器中可逆反应:2NO2(g)?N2O4(g)△H<0,下列叙述正确的是AC
A.单位时间内生成1molN2O4的同时生成2molNO2,达到平衡状态
B.达到平衡后,其它条件不变,升高温度,容器内气体颜色变浅
C.置于绝热的恒容容器中,容器中气体颜色不变时,说明达到平衡状态
D.加入适当的催化剂,NO2的转化率可以增大
(3)在100℃时,将0.400mol的NO2气体充入2L的容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| n(NO2)/mol | 0.400 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②升高温度后,平衡常数K将减低(填“增高”、“减低”或“不变”)
③若在相同情况下向该容器中只充入N2O4气体,要达到上述同样的平衡状态,N2O4的起始物质的量是0.200mol
(4)亚硝酸钠(NaNO2)是一种常见的食品添加剂,具有防腐和增色作用
①亚硝酸钠中氮元素的化合价为+3,由此推断其可能C.(填字母序号)
A.只有氧化性 B.只有还原性 C.既有氧化性,也有还原性
②已知亚硝酸属于弱酸,则NaNO2溶液显碱性;(填“酸性”、“中性”或“碱性”)原因是NO-+H2O?HNO2+OH-.(用离子方程式表示)
(5)肼-空气燃烧电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,放电时生成N2和水,则放电时负极电极反应式为N2H4-e-+4OH-=N2↑+4H2O.