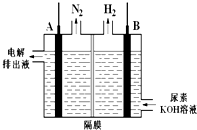
题目内容
6.生活中的问题常涉及化学知识,下列过程不涉及化学变化的是( )| A. | 用食醋除去暖瓶内的水垢 | |
| B. | 鸡蛋白溶液中加入硫酸铵饱和溶液后析出白色沉淀 | |
| C. | 淀粉溶液中加碘水变蓝 | |
| D. | 棉花织品和羊毛织品:分别灼烧闻气味 |
分析 A.用食醋除去暖瓶内的水垢是醋酸与氢氧化镁、碳酸钙反应生成可溶性盐的过程;
B.鸡蛋白溶液中加入硫酸铵饱和溶液后析出白色沉淀,该过程属于蛋白质的盐析;
C.淀粉遇碘单质变蓝,该过程淀粉遇碘反应生成络合物;
D.燃烧有新物质生成.
解答 解:A.用食醋除去暖瓶内的水垢是醋酸与氢氧化镁、碳酸钙反应生成可溶性盐的过程,有新物质生成属于化学变化,故A错误;
B.鸡蛋白溶液中加入硫酸铵饱和溶液后析出白色沉淀,该过程属于蛋白质的盐析,没有新物质的产生,属于物理过程,故B正确;
C.淀粉遇碘单质变蓝,该过程淀粉遇碘反应生成络合物,有新的物质生成,属于化学变化,故C错误;
D.燃烧有新物质生成,属于化学变化,故D错误.
故选B.
点评 本题考查了物理变化与化学变化的判断,题目难度不大,抓住是否有新的物质生成是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 22.4 L 乙烯和丙烯的混合气体中分子数为NA | |
| B. | 一定温度下,15 g甲醛和葡萄糖的混合物含O原子数为0.5 NA | |
| C. | 常温常压下,8.8 g乙酸乙酯中含有C-O键的个数为0.5 NA | |
| D. | 4 mL 15 mol•L-1浓硝酸与足量铜反应,生成NO2的分子数约为0.03 NA个 |
12.下列酸性氧化物和水化物的关系不对应的是( )
| A. | SiO2 H4SiO4 | B. | Cl2O HClO4 | C. | Mn2O7 HMnO4 | D. | N2O5 HNO3 |
14.已知由石墨制备金刚石的反应为:C(石墨)$\frac{\underline{\;一定条件\;}}{\;}$C(金刚石);△H>0,则下列两个反应中:C(石墨)+O2(g)═CO2(g);△H=a kJ/mol,C(金刚石)+O2(g)═CO2(g);△H=b kJ/mol,a与b的关系为( )
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
1. 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )
卡片:NO.28Date:2007.4.8
实验后的记录:
①Zn为阳极,Cu为阴极②H+向负极移动
③电子流动方向Zn→Cu④Cu极有H2产生
⑤若有1mol电子流过导线,则产生H2为0.5mol.
⑥正极的电极反应式:Zn-2e-═Zn2+.
 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )卡片:NO.28Date:2007.4.8
实验后的记录:
①Zn为阳极,Cu为阴极②H+向负极移动
③电子流动方向Zn→Cu④Cu极有H2产生
⑤若有1mol电子流过导线,则产生H2为0.5mol.
⑥正极的电极反应式:Zn-2e-═Zn2+.
| A. | ①②③ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ②③④ |
11.化学与社会生活密切相关,下列说法正确的是( )
| A. | 臭氧、乙醇溶液均可用于消毒杀菌且原理完全相同 | |
| B. | 半导体材料和光纤制品都是以硅为基本原料生产的 | |
| C. | 煤的干馏和石油的分馏均属化学变化 | |
| D. | 亚硝酸盐、二氧化硫均可以用作食品的防腐剂 |
18. 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
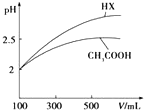
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时HX的电离平衡常数_大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值).
(5)标准状况下,将1.12L CO2通入100mL 0.75mol•L-1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时HX的电离平衡常数_大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值).
(5)标准状况下,将1.12L CO2通入100mL 0.75mol•L-1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
15.下列物质互为同分异构体的一组是( )
| A. | 35Cl和37Cl | B. | CH3COOH和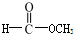 | C. | O2和O3 | D. | CH2=CH2和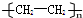 |