题目内容
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 常温常压下,44 g C3H8中含有的碳碳单键数为3 NA | |
| C. | 6.4 g铜粉与足量硫粉充分反应,失去的电子数为0.2 NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
分析 A.氯气溶于水中,只有少量的氯气与水反应生成氯化氢和次氯酸;
B.44g C3H8的物质的量为0.1mol,C3H8中含有2个碳碳单键,0.1mol丙烷中含有0.2mol碳碳单键;
C.铜粉与足量硫粉反应生成硫化亚铜;
D.过氧化钠中的阴离子为过氧根离子,1mol过氧化钠中含有1mol过氧根离子.
解答 解:A.0.1mol氯气溶于水,只有少量的氯气与水反应生成次氯酸和氯化氢,转移的电子小于0.1mol,转移的电子数目小于0.1NA,故A错误;
B.44g C3H8的物质的量为0.1mol,0.1mol丙烷中含有0.2mol碳碳单键,含有的碳碳单键数为2NA,故B错误;
C.6.4 g铜粉为0.1mol,与足量硫粉充分反应,失去的电子数为0.1 NA,故C错误;
D.1mol过氧化钠和氧化钠的混合物中含有2mol钠离子、1mol氧离子和过氧根离子,总共含有3mol阴阳离子,含有的阴、阳离子总数是3NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;选项A为易错点,注意氯气与水的反应中,只有少量的氯气与水反应生成氯化氢和次氯酸.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
15.下列物质互为同分异构体的一组是( )
| A. | 35Cl和37Cl | B. | CH3COOH和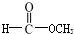 | C. | O2和O3 | D. | CH2=CH2和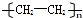 |
20.下列有关实验的叙述,正确的是( )
| A. | 分馏石油时,温度计的水银球必须插入液面下 | |
| B. | 用浓氨水洗涤做过银镜反应的试管 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加直至沉淀刚好溶解为止 | |
| D. | 蔗糖水解后,直接滴加新制氢氧化铜悬浊液并加热检验水解产物中的葡萄糖 |
10.“嫦娥一号”的四大科学目标之一是探测下列14种元素在月球上的含量和分布:K、Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、Ti(钛)、Na、Mn、Cr(铬)、Gd(钆),其中属于主族元素的有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
17.下列有关元素周期表中的某些推断正确的是( )
| A. | 位于同一主族的元素的价电子数相同,则各元素的常见化合价也一定相同 | |
| B. | 碱金属族元素同卤族元素一样,其单质的熔沸点随元素原子序数的增大而逐渐升高 | |
| C. | 若x是ⅡB族中元素的原子序数,那么原子序数为x+1的元素是ⅢA族 | |
| D. | 在周期表中金属和非金属元素的分界线附近的元素是过渡元素 |
14.化学键是( )
| A. | 只存在于分子之间 | |
| B. | 是相邻的两个或多个原子或离子之间强烈的相互作用 | |
| C. | 只存在于离子之间 | |
| D. | 是相邻的两个或多个离子之间强烈的静电作用 |
15.某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
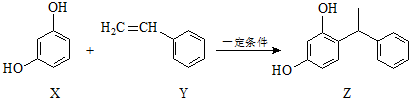
下列叙述错误的是( )

下列叙述错误的是( )
| A. | X、Y和Z均能使溴水褪色 | |
| B. | X和Z均能与NaHCO3溶液反应放出CO2 | |
| C. | 上述反应X+Y→Z属于加成反应 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
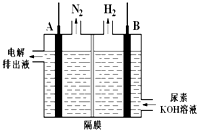
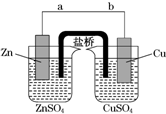 某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题:
某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题: