题目内容
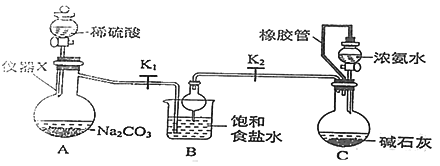
【题目】工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。
样品12.0 g ![]() 溶液
溶液![]() 沉淀
沉淀![]() 固体19.7 g
固体19.7 g
(1)如何检验氯化钡溶液已过量____________
(2)检验沉淀是否洗涤干净所用到的试剂是____________
(3)样品中Na2CO3的质量分数为_________(小数点后保留1位)
【答案】取少量上层清液于试管中,加入硫酸钠溶液,若有白色沉淀生成,则氯化钡溶液已过量,反之则不过量(合理即可) 硝酸酸化的AgNO3溶液(合理即可) 88.3%
【解析】
(1)检验氯化钡溶液已过量,即检验Ba2+的存在,所以应加入含SO42-的物质。考虑到原溶液中检验,只能加入硫酸钠溶液。
(2)检验沉淀是否洗涤干净,即检验沉淀表面是否存在Cl-,所用到的试剂是硝酸酸化的硝酸银。
(3)计算Na2CO3的质量分数时,可利用Na2CO3——BaCO3,先求出Na2CO3的质量,再除以12.0,得出质量分数。
(1)检验氯化钡溶液已过量,即检验Ba2+的存在,所以应加入硫酸钠溶液,具体操作为:取少量上层清液于试管中,加入硫酸钠溶液,若有白色沉淀生成,则氯化钡溶液已过量,反之则不过量(合理即可)。答案为:取少量上层清液于试管中,加入硫酸钠溶液,若有白色沉淀生成,则氯化钡溶液已过量,反之则不过量(合理即可);
(2)检验沉淀是否洗涤干净,即检验沉淀表面是否存在Cl-,所用到的试剂是硝酸酸化的硝酸银。答案为:硝酸酸化的AgNO3溶液(合理即可);
(3)设样品中Na2CO3的质量为x
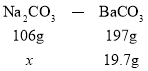
从而求出x=10.6g,样品中Na2CO3的质量分数为![]() =88.3%。答案为:88.3%。
=88.3%。答案为:88.3%。

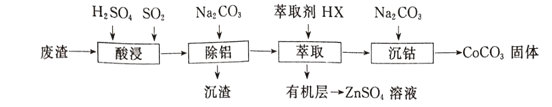
【题目】CoCO3可用作选矿剂、催化剂及家装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式____________________。
(2)“除铝”过程中需要调节溶液pH的范围为_______________ 。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
(4)简述洗涤沉淀的操作____________________________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为 ____________________。