题目内容
【题目】CoCO3可用作选矿剂、催化剂及家装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
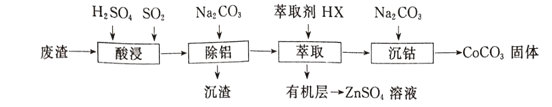
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式____________________。
(2)“除铝”过程中需要调节溶液pH的范围为_______________ 。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
(4)简述洗涤沉淀的操作____________________________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为 ____________________。
【答案】Co2O3+SO2+H2SO4=2CoSO4+H2O 5.0~5.4 分液漏斗、烧杯 向有机层中加入适量的硫酸溶液充分振荡,静置,分离出水层 向漏斗中加蒸馏水至没过沉淀,待水自然流完后,重复上述操作2-3次 Co3O4
【解析】
(1)从最终产物看,酸溶时,Co2O3被还原为Co2+,SO2被氧化为SO42-,
“酸溶”时发生氧化还原反应的化学方程式Co2O3+SO2+H2SO4=2CoSO4+H2O。
答案为:Co2O3+SO2+H2SO4=2CoSO4+H2O
(2)“除铝”过程中需要调节溶液pH的范围,目的是让Al3+全部转化为沉淀,而Zn2+不生成沉淀,所以pH的范围应为5.0~5.4。答案为:5.0~5.4
(3)在实验室里,萃取操作用到的玻璃仪器主要有分液漏斗、烧杯。
答案为:分液漏斗、烧杯
上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),从反应中可以看出,此反应为可逆反应,所以加硫酸可实现让ZnSO4进入水层的目的。从而得出由有机层获取ZnSO4溶液的操作是向有机层中加入适量的硫酸溶液充分振荡,静置,分离出水层。
ZnX2(有机层)+H2SO4(水层),从反应中可以看出,此反应为可逆反应,所以加硫酸可实现让ZnSO4进入水层的目的。从而得出由有机层获取ZnSO4溶液的操作是向有机层中加入适量的硫酸溶液充分振荡,静置,分离出水层。
答案为:向有机层中加入适量的硫酸溶液充分振荡,静置,分离出水层
(4)洗涤沉淀的操作是:向漏斗中加蒸馏水至没过沉淀,待水自然流完后,重复上述操作2-3次。
答案为:向漏斗中加蒸馏水至没过沉淀,待水自然流完后,重复上述操作2-3次。
(5)从化学式CoCO3可以看出,n(Co)=n(C)=![]() ,
,
m(Co)=0.03mol×59g/mol=1.77g
m(O)=2.41g-1.77g=0.64g
n(O)=![]()
n(Co):n(O)= 0.03mol:0.04mol=3:4
则该钴氧化物的化学式为Co3O4。
答案为:Co3O4

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案