题目内容
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5mol/L Li2SO4水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是( )
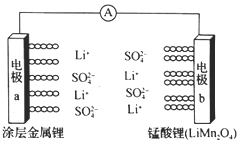
A.该电池放电时,溶液中的SO42-向电极b移动
B.该电池负极的电极反应式为:2Li+2H2O=2LiOH+H2↑
C.电池充电时,阳极的电极反应式为:Li2Mn2O4-e-=LiMn2O4+Li+
D.电池充电时,外加直流电源的正极与电极a相连
【答案】C
【解析】
电池放电时为原电池原理,电极a上Li失电子发生氧化反应,作原电池负极,电极b上LiMn2O4在正极得到电子发生还原反应生成Li2Mn2O4,电池充电时,外加直流电源的正极与正极电极b相连为阳极发生氧化反应,外加直流电源的负极与负极电极a相连为阴极发生还原反应,进行分析判断。
A.该电池放电时,溶液中的SO42-向负极电极a移动,A错误;
B.电池放电时为原电池原理,电极a上Li失电子发生氧化反应,作原电池负极,电极反应式为:Li-e-=Li+,B错误;
C.电池充电时,外加直流电源的正极与正极电极b相连为阳极发生氧化反应,电极反应与正极相反,则反应式为:Li2Mn2O4-e-=LiMn2O4+Li+,C正确;
D.电池充电时,外加直流电源的正极与正极电极b相连为阳极发生氧化反应,D错误;
故合理选项是C。

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目