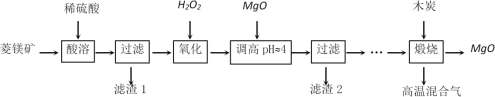
题目内容
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是
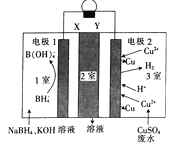
A. X、Y依次为阳离子、阴离子选择性交换膜
B. 负极的电极反应式:BH4-+8OH-一8e-═B(OH)4-+4H2O
C. 2室流出的溶液中溶质为Na2SO4和K2SO4
D. 电路中每转移1mol电子,电极2上有32gCu析出
【答案】D
【解析】
由图中得失电子可知,电极1为负极,电极2为正极,负极发生:BH4-+8OH-一8e-═B(OH)4-+4H2O,正极发生还原反应,废水中Cu2+及H+在正极上得到电子被还原,1室中Na+、K+透过X膜向2室迁移,SO42-透过Y膜向2室迁移,故X、Y依次为阳离子、阴离子选择性交换膜,在2室流出的溶液为Na2SO4和K2SO4溶液。
A、由图中得失电子可知,电极1为负极,电极2为正极,1室中Na+、K+透过X膜向2室迁移,SO42-透过Y膜向2室迁移,故X、Y依次为阳离子、阴离子选择性交换膜,在2室流出的溶液为Na2SO4和K2SO4溶液,故A正确;
B、在原电池中负极发生氧化反应,故B项正确;
C、由A分析可知:在2室流出的溶液为Na2SO4和K2SO4溶液,故C正确;
D、正极发生还原反应,废水中Cu2+及H+在正极上得到电子被还原,故D错误。
故选D。

【题目】(一)在密闭容器中,保持一定温度进行如下反应:N2(g)+3H2(g) ![]() 2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3,回答下列问题:
2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3,回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数K值越大,表明建立平衡时___________(填序号)。
A. N2的转化率越高 B. NH3的产量越大
C. 正反应进行得越彻底 D. 化学反应速度越快
(3)a与b的关系是:a ____ b(填>、<、=)
(二)在密闭容器中发生下列反应: I2(g)+H2(g)![]() 2HI(g)(正反应吸热)
2HI(g)(正反应吸热)
起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”“减小”或“不变”)填入相应的表格。
编号 | 反应条件 | 反应速率 |
① | 升高温度 | ______ |
② | 再充入a mol H2 | _______ |
③ | 将容器容积扩大为原来2倍 | _______ |
④ | 容积不变通入b mol Ne(g) | _______ |