题目内容
2.将20克NaOH溶于水中,配制成1L溶液,则该溶液的物质的量浓度为( )(已知NaOH的摩尔质量为40g/mol)
| A. | 0.1mol/L | B. | 0.5mol/L | C. | 4mol/L | D. | 1mol/L |
分析 计算氢氧化钠的物质的量,依据C=$\frac{n}{V}$计算溶液的物质的量浓度.
解答 解:20克NaOH的物质的量=$\frac{20g}{40g/mol}$=0.5mol,溶液的体积为1L,溶液的物质的量浓度为$\frac{0.5mol}{1L}$=0.5mol/L,
故选:B.
点评 本题考查了溶液物质的量浓度的计算,熟悉浓度计算公式是解题关键,题目难度不大.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
13.下列说法不正确的是( )
| A. | 明矾和漂白粉均可用于自来水的杀菌、消毒 | |
| B. | 新制的0.1mol/L氯水中加入少量的CaCO3固体,HClO的物质的量浓度减小 | |
| C. | Na2O和Na2O2都能与H2O反应,其反应原理不相同 | |
| D. | O3、H2O2、SO2、Na2O2均有漂白性,其原理不尽相同 |
10.设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 常温常压下,32g氧气所含的原子数为NA | |
| B. | 标准状况下,22.4L 四氯化碳的分子数为NA | |
| C. | 0℃,101KPa下,44.8L氮气所含有的分子数为2NA | |
| D. | 常温常压下,1mol氦气含有的分子数为2NA |
17.下列对化学反应的认识,不正确的是( )
| A. | 化学反应必然引起物质状态的变化 | B. | 化学反应会引起化学键的变化 | ||
| C. | 化学反应必然伴随着能量的变化 | D. | 化学反应会产生新的物质 |
14.据权威刊物报道,1996年科学家在宇宙中发现H3分子.甲、乙、丙、丁四位学生对此报道的认识正确的是( )
| A. | 甲认为上述发现绝对不可能,因为H3分子违背了共价键理论 | |
| B. | 丁认为如果上述的发现存在,则证明传统的价键理论并不完善 | |
| C. | 丙认为H3分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H3+ | |
| D. | 乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种同素异形体 |
11.由乙醛和乙酸乙酯组成的混合物中,若含碳的质量分数为A%,则此混合物中含氢的质量分数为( )
| A. | (100-$\frac{7A}{6}$)% | B. | 10A% | C. | ($\frac{A}{6}$)% | D. | 6A% |
12.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 在常温常压下,11.2 L Cl2含有的分子数为0.5NA | |
| B. | 在常温常压下,1 mol氢气含有的分子数为NA | |
| C. | 在常温常压下,32 g氧气含原子数为NA | |
| D. | 标准状况下,1mol水的体积约为22.4L |
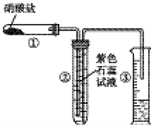 某校化学兴趣小组的同学对硝酸盐的受热分解进行探究.他们设计了如图装置分别加热了NaNO3、Cu(NO3)2、AgNO3.(加热及夹持装置未画出)
某校化学兴趣小组的同学对硝酸盐的受热分解进行探究.他们设计了如图装置分别加热了NaNO3、Cu(NO3)2、AgNO3.(加热及夹持装置未画出)