题目内容
12.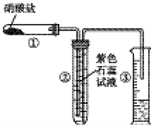 某校化学兴趣小组的同学对硝酸盐的受热分解进行探究.他们设计了如图装置分别加热了NaNO3、Cu(NO3)2、AgNO3.(加热及夹持装置未画出)
某校化学兴趣小组的同学对硝酸盐的受热分解进行探究.他们设计了如图装置分别加热了NaNO3、Cu(NO3)2、AgNO3.(加热及夹持装置未画出)(1)甲同学加热的是NaNO3.加热过程发现:装置②中产生气泡,部分石蕊试液被压至装置③中,且石蕊试液不变色;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素且显+3价.请写出NaNO3受热分解的化学方程式:2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑;
(2)乙同学加热的是Cu(NO3)2.加热过程发现:装置②中也有气泡产生,但在上升的过程中消失.装置①中的固体逐渐变为黑色.请写出Cu(NO3)2受热分解的化学方程式:2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑,实验过程中还应看到的现象为石蕊试液逐渐变为红色,液体几乎不被压至装置③中.
(3)丙同学加热的是AgNO3.加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃.石蕊试液也逐渐变为红色,有少量液体被压至装置③中.装置①中的固体逐渐变为黑色.丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
(Ⅰ)4AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag2O+4NO2↑+O2↑,
(Ⅱ) 2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
请你分析,可能正确的是哪一个并说明理由:Ⅱ正确,如果Ⅰ正确,则装置②中的气泡应全部消失,不会有液体被压至装置③中.
请你设计一个简单的实验证明你的结论是正确的:向装置①中的残留固体加入少量浓硝酸,产生红棕色气体;
(4)由上述3个实验的结果,请你推测:硝酸盐受热分解的产物可能与硝酸盐中金属的活泼性不同有关.
分析 (1)装置②中产生气泡,部分石蕊试液被压至装置③中,且石蕊试液不变色;用带火星的木条检验②中的气体,木条复燃,说明生成物有氧气,分析装置①中剩余的固体得知,剩余固体中含有N元素且显+3价,说明生成物有亚硝酸钠,然后根据质量守恒配平;
(2)装置②中也有气泡产生,但在上升的过程中消失,说明生成物有二氧化氮和氧气,装置①中的固体逐渐变为黑色,说明生成物有氧化铜,请然后根据质量守恒配平;根据二氧化氮、氧气恰好与水反应生成硝酸来分析;
(3)根据反应4NO2+O2+2H2O=4HNO3来分析;根据金属单质与浓硝酸反应产生红棕色二氧化氮气体,而金属氧化物与硝酸反应不产生红棕色二氧化氮气体;
(4)根据硝酸盐中金属的活泼性不同,产物也不同.
解答 解:(1)由题目信息,可知生成物有氧气、亚硝酸钠,方程式为:2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑,
故答案为:2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑;
(2)由题目信息,可知生成物有二氧化氮和氧气,氧化铜,方程式为:2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑;二氧化氮、氧气恰好与水反应生成硝酸,方程式为:4NO2+O2+2H2O=4HNO3,硝酸能使石蕊试液逐渐变为红色,液体几乎不被压至装置③中,
故答案为:2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑;石蕊试液逐渐变为红色,液体几乎不被压至装置③中;
(3)根据反应4NO2+O2+2H2O=4HNO3可知;反应Ⅰ产生的气体恰好反应,反应Ⅱ产生的气体中氧气过量,所以Ⅱ正确,如果Ⅰ正确,则装置②中的气泡应全部消失,不会有液体被压至装置③中,
Ag与浓硝酸反应产生红棕色二氧化氮气体,而Ag2O与硝酸反应不产生红棕色二氧化氮气体,所以向装置①中的残留固体加入少量浓硝酸,产生红棕色气体,
故答案为:Ⅱ正确,如果Ⅰ正确,则装置②中的气泡应全部消失,不会有液体被压至装置③中; 向装置①中的残留固体加入少量浓硝酸,产生红棕色气体;
(4)硝酸盐受热分解的产物可能与硝酸盐中金属的活泼性不同有关;
故答案为:硝酸盐中金属的活泼性不同.
点评 本题主要考查了硝酸盐的受热分解产物的确定,注意根据实验现象确定反应产物,难度中等.

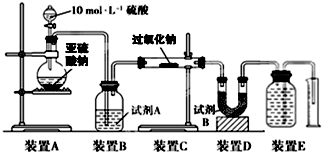
 醇的化学性质主要由羧基官能团所决定,如1-丁醇在银催化的条件下能与氧气反应生成正丁醛.相应醇和醛的有关物理性质如表:
醇的化学性质主要由羧基官能团所决定,如1-丁醇在银催化的条件下能与氧气反应生成正丁醛.相应醇和醛的有关物理性质如表:| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1-丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
(B中为足量的重铬酸钠的酸性溶液,A中装有适量的1-丁醇和少量沸石,反应温度为93℃左右,E中为馏出物)
回答下列问题:
(1)上述装置图中,B仪器的名称是滴液漏斗,其使用前必须进行的操作是检漏.
(2)D仪器的名称是直形冷凝管,冷水应从b处进入(填a或b).
(3)实验操作过程中,若加热后发现未加沸石,则采取的正确方法是冷却后补加.
(4)将正丁醛粗产品提纯,要先进行操作Ⅰ,再进行操作Ⅱ,则操作Ⅰ是分液(填操作名称).
(5)反应温度应保持在93℃左右,其原因是既可保证正丁醛要及时蒸出,又可避免其被进一步氧化.
(6)上述装置图中,对应温度计C1、C2的放置判断正确的是c.
a.C1、C2均错误 b.C1错误C2正确 c.C1、C2均正确 d.C1正确C2错误
(7)正丁醛与新制的Cu(OH)2发生反应,该反应的化学方程式为CH3CH2CH2CHO+NaOH+2Cu(OH)2$\stackrel{△}{→}$CH3CH2CH2COONa+Cu2O↓+3H2O.
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是( )
| A. | Cl- 不可能存在 | B. | 100 mL溶液中含0.01 mol CO32- | ||
| C. | K+一定存在 | D. | Ba2+一定不存在,Mg2+可能存在 |
(已知NaOH的摩尔质量为40g/mol)
| A. | 0.1mol/L | B. | 0.5mol/L | C. | 4mol/L | D. | 1mol/L |
 过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2).已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作进行判断.
过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2).已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作进行判断.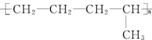 的单体是CH2═CH-CH3、CH2═CH2;(写结构简式)
的单体是CH2═CH-CH3、CH2═CH2;(写结构简式)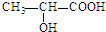 )中的官能团名称是:羟基、羧基;两分子乳酸在浓硫酸加热的条件下,可生成一种环状酯,写出此酯的结构简式:
)中的官能团名称是:羟基、羧基;两分子乳酸在浓硫酸加热的条件下,可生成一种环状酯,写出此酯的结构简式: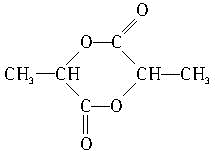 ;
;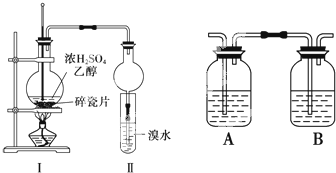 某化学兴趣小组用如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.
某化学兴趣小组用如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.