��Ŀ����
��������������Ҫ��Fe2O3��SiO2��Al2O3��MgO�����ʣ��Ʊ��������Ĺ����������£�
��1���������������Ҫ�ʵ�������Ŀ���Ǣ�������Ľ����ʣ��� ��
��2������ԭ���ǽ�Fe3��ת��ΪFe2����ͬʱFeS2������ΪSO42�����÷�Ӧ�����ӷ���ʽΪ ��
��3��Ϊ�ⶨ��������������Һ��Fe3�������Կ��Ƽ���FeS2������ʵ�鲽��Ϊ��ȷ��ȡһ���������������Һ����ƿ�У�����HCl���Թ���SnCl2���ټ�HgCl2��ȥ������SnCl2���Զ�����������Ϊָʾ������K2Cr2O7����Һ�ζ����йط�Ӧ����ʽ���£�
2Fe3����Sn2����6Cl����2Fe2����SnCl62����
Sn2����4Cl����2HgCl2��SnCl62����Hg2Cl2����
6Fe2����Cr2O72����14H����6Fe3����2Cr3����7H2O��
����SnCl2����������ⶨ��Fe3���� ���ƫ�ߡ�����ƫ�͡��������䡱����ͬ����
��������HgCl2����ⶨ��Fe3���� ��
��4���ٿ�ѡ�� �����Լ���������Һ�к���Fe3+������Fe3+��ԭ���� �������ӷ�Ӧ����ʽ��ʾ����
����֪����������������������ʽ����ʱ��Һ��pH���±���
| ������ | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| ��ʼ���� | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| ��ȫ���� | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
ʵ���ѡ�õ��Լ��У�ϡHNO3��Ba(NO3)2��Һ������KMnO4��Һ��NaOH��Һ��Ҫ���Ʊ������в������ж����塣
������ɡ����ˡ������Һģ���Ʊ���������ʵ�鲽�裺
a.������ ��
b.������ ��
c.���룬ϴ�ӣ�
d.��ɣ���ĥ��
��1������Fe3+��ˮ�⣨2��14Fe3++FeS2+8H2O=15Fe2++2SO42��+16H+
��3����ƫ�� ��ƫ�� ��4����KSCN�� 4Fe2����O2��4H����4Fe3����2H2O
4Fe2����O2��4H����4Fe3����2H2O
��a.����Һ�м�����������Ը��������Һ������
b.�μ�NaOH��Һ��������ҺΪpHΪ3.2��3.8
���������������1��Fe3+ˮ���������������������������������Fe3+ˮ�⡣��2��Fe3+��FeS2����Fe2+��SO42-��FeS2��FeΪ+2�ۡ�SΪ-1�ۣ����ݵ�ʧ������ȡ�����غ㡢�����غ���ƽ����3����SnCl2��������Fe3+������ȫ����ԭ�����ɵ�Fe2+���ʵ���ƫ�ͣ�������ƫ�ͣ�������HgCl2��������Sn2+Ҳ�ܱ��ظ������Һ������������ƫ�ߡ���4����Fe3+��SCN-����Ѫ��ɫ��Һ��Fe3+�뱽��������ɫ��Һ����Һ�е�Fe2+�ܱ������е�������������Fe3+��������ʱ��ʹ�����ᣬʹ�ø��������Һ�������������NO������Ⱦ����������ʱʹFe3+��ȫ�������������Ӳ����������Լ�����������Һ����pH3.2��3.8��
���㣺 �������������Ŀ��� ���ӷ���ʽ����д ������ ���ӵļ��� ��ѧʵ�鷽�������

 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�����ʵ�������ȷ����
| A��ʢ��NaOH��Һʱ��ʹ�ô���������ĥ��ƿ |
| B���ñ���ȡ��ˮ�е���ʱ������ı���Һ�ӷ�Һ©���¿ڷų� |
| C��NaCl��Һ�����ᾧʱ�����������о���������ʣ������Һ�弴ֹͣ���� |
| D����������ˮ�ķ�Ӧ��ʵ��ʱ����ȡ�̶���С�Ľ����ƣ�����ֽ����������ú�ͣ������ձ��У��������η�̪��Һ���ټ�������ˮ��Ȼ��۲첢��¼ʵ������ |
�й��ܺ�������������ʼ��±���
| ��ѧʽ | �ܶȻ�������ʱ��Ksp | ������ȫʱ��pH | �Ȼ��ܾ�������� |
| Co(OH) 2 | 5.9��10-15 | 9.4 | CoCl2��6H2O�ʺ�ɫ���������ȶ���110ºC��120ºCʱ��ˮ�����ɫ��ˮ�Ȼ��� |
| Fe(OH) 2 | 1.6��10-14 | 9.6 | |
| Fe(OH) 3 | 1.0��10-35 | x |
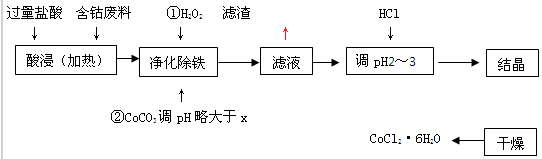
�ú��ܷ��ϣ��������������Ʊ��Ȼ��ܣ�Co+2HCl=CoCl2+H2�������������£�
�Իش�
��1���������������У�д������CoCO3�����ܣ���pHʱ��Ӧ�����ӷ���ʽ
��2����Һ�У�Fe3+����1.0��10-5mol/Lʱ������ΪFe3+������ȫ���Լ��������£�Fe(OH) 3������ȫʱ����x= ��
��3���ڲ�����CoCO3��pH�Դ���x��ԭ���� ��
��4����Һ������������ �� ��
��5��Ϊ�˷�ֹCoCl2��6H2O��ˮ�������ʱ�˲��õķ���������� �� ��
��15�֣�
ij��ѧ��ȤС���ͬѧΪ��ȡ���������飬�������ϵ�֪��
NaBr��H2SO4 HBr��NaHSO4
HBr��NaHSO4
CH3CH2OH��HBr CH3CH2Br��H2O
CH3CH2Br��H2O
��ѧ��ȤС�����ʵ��ԭ���������ͼ��װ�á�
�����������������գ��й������б����£�
| | �Ҵ� | ������ |
| ״̬ | ��ɫҺ�� | ��ɫҺ�� |
| �ܶȣ�g �� cm-3 | 0.8 | 1.4 |
| �е㣯�� | 78.5 | 119.0 |
| �۵㣯�� | -l30 | 38.4 |
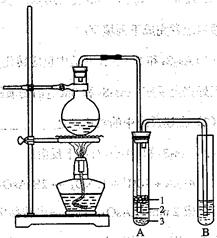
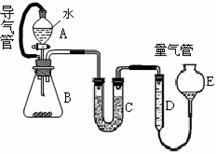
��1��Բ����ƿ�м���ķ�Ӧ�����廯�ơ� ��2:1�����ᡣ���������2��1���������õ�����Ϊ (ѡ���ţ�
a���ձ� b�������� c����Ͳ d������ƿ e.�ζ���
��2���������ﵼ��ʢ�б�ˮ�������Թ�A�У��Թ�A�е����ʷ�Ϊ���㣨��ͼ��ʾ���������ڵ�
�㣻
��3����Ũ���������ʵ�飬���Թ�A�л�õ��л�����ػ�ɫ����ȥ��������Ӧ��
�� (ѡ���ţ�Ȼ���ٽ��� һ���������ɣ�
a����ˮ�Ȼ��� b����������Һ c�����Ȼ�̼ d������������Һ
��4��ʵ������У�ͬѧ�����������Ӳ�����©��������ʦ���������װ���е��������Ӳ��ֶ��ijɱ������ӿڣ���ԭ���ǣ� ��
��5���������ȡ�õ���ˮ�Ҵ���57.5mL,���õ��Ĵ�������������52.0mL����������IJ���Ϊ ��
(12��)Ϊ��֤�����ԣ�Cl2>Fe3+>SO2��ijС������ͼ��ʾװ�ý���ʵ��(�г�������A�еļ���װ�����ԣ��������Ѿ��������)ʵ��������£�
���ɼ�K1��K4��ͨ��һ��ʱ��N2���ٽ�T�͵��ܲ���B�У�����ͨ��N2��Ȼ��ر�K1��K3��K4��
����a���μ�һ������Ũ���ᣬ��A���ȣ�
��B�е���Һ���ʱ��ֹͣ���ȣ��н����ɼ�K2��
��������b��ʹԼ2ml����Һ����D�Թ��У��������е����ӣ�
V�����ɼ�K3������c������70�������ᣬһ��ʱ���н����ɼ�K3��
���������Թ�D���ظ����̢�������B��Һ�е����ӣ�
��1�����̢��Ŀ����______________________��
��2�����н������ҺΪ__________________��
��3��A�з�����Ӧ�Ļ�ѧ����ʽΪ__________________________________��
��4����70����������ȡSO2����Ӧ���ʱ���98��������죬ԭ����______________
��5�����̢��м���B��Һ���Ƿ���������IJ�����________________________________
��6���ס��ҡ�����λͬѧ�ֱ����������ʵ�飬���ǵļ����һ���ܹ�֤��������Cl2>Fe3+>SO2����
| | ����IV B��Һ�к��е����� | ����VI B��Һ�к��е����� |
| �� | ��Fe3+��Fe2+ | ��SO42�� |
| �� | ����Fe3+����Fe2+ | ��SO42�� |
| �� | ��Fe3+��Fe2+ | ��Fe2+ |