��Ŀ����
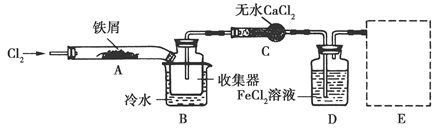
(12��)Ϊ��֤�����ԣ�Cl2>Fe3+>SO2��ijС������ͼ��ʾװ�ý���ʵ��(�г�������A�еļ���װ�����ԣ��������Ѿ��������)ʵ��������£�
���ɼ�K1��K4��ͨ��һ��ʱ��N2���ٽ�T�͵��ܲ���B�У�����ͨ��N2��Ȼ��ر�K1��K3��K4��
����a���μ�һ������Ũ���ᣬ��A���ȣ�
��B�е���Һ���ʱ��ֹͣ���ȣ��н����ɼ�K2��
��������b��ʹԼ2ml����Һ����D�Թ��У��������е����ӣ�
V�����ɼ�K3������c������70�������ᣬһ��ʱ���н����ɼ�K3��
���������Թ�D���ظ����̢�������B��Һ�е����ӣ�
��1�����̢��Ŀ����______________________��
��2�����н������ҺΪ__________________��
��3��A�з�����Ӧ�Ļ�ѧ����ʽΪ__________________________________��
��4����70����������ȡSO2����Ӧ���ʱ���98��������죬ԭ����______________
��5�����̢��м���B��Һ���Ƿ���������IJ�����________________________________
��6���ס��ҡ�����λͬѧ�ֱ����������ʵ�飬���ǵļ����һ���ܹ�֤��������Cl2>Fe3+>SO2����
| | ����IV B��Һ�к��е����� | ����VI B��Һ�к��е����� |
| �� | ��Fe3+��Fe2+ | ��SO42�� |
| �� | ����Fe3+����Fe2+ | ��SO42�� |
| �� | ��Fe3+��Fe2+ | ��Fe2+ |
��1���ų�װ���е�����������������2������������Һ����3��MnO2+4HCl(Ũ) MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
��4��70%�������е�H+��Ũ�ȱ�98%�������е�H+��Ũ�ȴ�5��ȡ����B��Һ���Թ��У�����������ϡ�����ữ���ٵμӼ����Ȼ�����Һ�����а�ɫ�������ɣ�֤����ҺB�������������6���ҡ�����
����

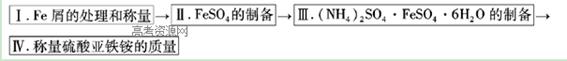
��������������Ҫ��Fe2O3��SiO2��Al2O3��MgO�����ʣ��Ʊ��������Ĺ����������£�
��1���������������Ҫ�ʵ�������Ŀ���Ǣ�������Ľ����ʣ��� ��
��2������ԭ���ǽ�Fe3��ת��ΪFe2����ͬʱFeS2������ΪSO42�����÷�Ӧ�����ӷ���ʽΪ ��
��3��Ϊ�ⶨ��������������Һ��Fe3�������Կ��Ƽ���FeS2������ʵ�鲽��Ϊ��ȷ��ȡһ���������������Һ����ƿ�У�����HCl���Թ���SnCl2���ټ�HgCl2��ȥ������SnCl2���Զ�����������Ϊָʾ������K2Cr2O7����Һ�ζ����йط�Ӧ����ʽ���£�
2Fe3����Sn2����6Cl����2Fe2����SnCl62����
Sn2����4Cl����2HgCl2��SnCl62����Hg2Cl2����
6Fe2����Cr2O72����14H����6Fe3����2Cr3����7H2O��
����SnCl2����������ⶨ��Fe3���� ���ƫ�ߡ�����ƫ�͡��������䡱����ͬ����
��������HgCl2����ⶨ��Fe3���� ��
��4���ٿ�ѡ�� �����Լ���������Һ�к���Fe3+������Fe3+��ԭ���� �������ӷ�Ӧ����ʽ��ʾ����
����֪����������������������ʽ����ʱ��Һ��pH���±���
| ������ | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| ��ʼ���� | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| ��ȫ���� | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
ʵ���ѡ�õ��Լ��У�ϡHNO3��Ba(NO3)2��Һ������KMnO4��Һ��NaOH��Һ��Ҫ���Ʊ������в������ж����塣
������ɡ����ˡ������Һģ���Ʊ���������ʵ�鲽�裺
a.������ ��
b.������ ��
c.���룬ϴ�ӣ�
d.��ɣ���ĥ��
��������ƵĴ��ȿ��õζ������вⶨ��ԭ���ǣ�2S2O32��+ I2 �� S4O62��+ 2I-
38.����100 mL0.0500 mol/L I2��Һ������Ҫ�������� ��ѡ���ţ���
a��100 mL����ƿ b����Ͳ c���ձ� d��������
�ζ��ܱ���ʹ���¶ȣ�20oC; �ζ��ܵ���С�̶�Ϊ mL��
39.ȡ2 .500g�����ʵ�Na2S2O3��5H2O�������50mL��Һ��ÿ��ȡ10.00mL������ƿ���2�ε���Ϊָʾ��������0.0500 mol/L I2��Һ�ζ���ʵ����������(��3�γ�����Ϊ 0.00���յ������ͼ; ���ʲ��μӷ�Ӧ)��
| ��� | 1 | 2 | 3 |
| ����I2��Һ�����/mL | 19.98 | 20.02 | |
Na2S2O3?5H2O(ʽ��248)�����������ǣ�����4λС���� ��
40.�����ʵ����ƫ�͵IJ����� ��ѡ���ţ���
a. �ζ�ʱ�ζ����е�Һ�������ƿ��
b. ��ƿ������ˮϴ��������װ�������Һ
c. δ�ñ�Һ��ϴ�ζ���
d. ��ʱ��Һ������ƿ��
����ͭ�����ڲ�ͬ�¶��¿�ʧȥ���ֻ�ȫ���ᾧˮ�����ֽ�������ijѧ���ڲ�ͬ�¶��¸�8.000 g����ͭ������ȣ��¶������ߣ���ʵ������¼���£�
| ʵ����� | �¶ȣ��棩 | ��ȴ��ʣ������������g�� |
| 1 | 102 | 6.848 |
| 2 | 113 | 5.696 |
| 3 | 258 | 5.120 |
| 4 | 570 | 2.560 |
��1����1��ʵ�����������ʧȥ�ᾧˮ��������_____ g��
��2��ͨ������ȷ���ڶ���ʵ���������ʵĻ�ѧʽΪ______________��
��3�����Ĵ�ʵ���ʣ�����Ϊһ�ֺ�ɫ��ĩ������Ϊ����������ú�ɫ��ĩ�ܽ���ϡ�����У�������Ҫ0.50mol/L��ϡ������ٺ�������д��������̣�
�Ȼ��Ƴ����ڵ�·�ڱ��������������������ˮ�������������ʡ�ʵ�����ù�ҵ����ʯ����������Al2O3��Fe2O3�����ʣ��Ʊ��Ȼ��Ƶ���Ҫ�������£� ���������գ�
���������գ�
��1������ʹ�õ���������ʵ���Ũ��ԼΪ6.0mol/L������36.5%�����ᣨ�ܶ�Ϊ1.2g/mL������6.0mol/L������100mL������IJ��������в���������Ͳ����ͷ�ιܡ� ����Ҫ��ȡ36.5%������ mL�����ƹ����У���������������ȷ�����в���������Ũ��ƫС���� ��
| A������ҡ�Ⱥ���Һ����ڿ̶��� |
| B������ʱ��������ƿ�Ŀ̶��� |
| C������Һת������ƿ��û��ϴ���ձ��Ͳ���������ת�붨�ݲ��� |
| D�������ˮ�����˿̶��ߣ�ȡ������ˮʹҺ��ǡ�õ��̶��� |
��3����������ʯ��ˮ������Ŀ���Ƿ�ֹ�������ӷ���ʽ��ʾ���� ��
��4����������Ҫ�ɷ��У�д��ѧʽ�� ��
��5������������IJ��������� �� ��
��6���Ƶõ��Ȼ��ƿ���ͨ�����²���ⶨ�䴿�ȣ�
�ٳ�ȡ5.5g��ˮ�Ȼ�����Ʒ�����ܽ⣻�۵�������Na2CO3��Һ����ַ�Ӧ����ˣ��� �� ���ݳ��������õ�4.3g̼��ƣ����Ȼ��Ƶ���������Ϊ ����ʵ������淶���ⶨ���ƫ�ͣ���ԭ���� ��