题目内容
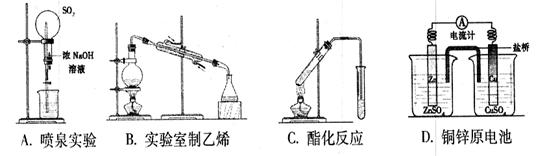
下列实验操作正确的是
| A.盛放NaOH溶液时,使用带玻璃塞的磨口瓶 |
| B.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 |
| C.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
| D.做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 |
C
解析试题分析:A、玻璃中含有二氧化硅,二氧化硅能和氢氧化钠溶液反应生成黏性较强的硅酸钠,是玻璃塞和瓶口粘合在一起,不易打开,应该用橡皮塞,A不正确;B、苯的密度小于水的,萃取溴时,苯层在上层,溴的苯溶液从分液漏斗上口放出,B不正确;C、NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热,利用余热将其蒸干,C正确;D、做钠与水的反应实验时,烧杯中应该用先加入适量的蒸馏水,并滴入几滴酚酞试液,然后再把钠投入到水中,D不正确,答案选C。
考点:考查化学实验基本操作的正误判断

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案对以下实验装置图的说法正确的是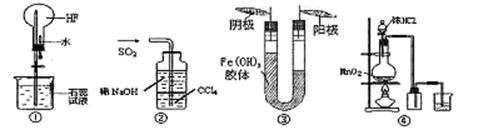
| A.利用图①装置做喷泉实验 |
| B.利用图②装置吸收尾气SO2 |
| C.利用图③装置进行胶体电泳实验可以说明Fe(OH)3胶体带正电荷 |
| D.利用图④装置用MnO2和浓盐酸制备并收集Cl2 |
用下列实验装置进行相应实验,能达到实验目的的是
| A.用图1所示装置分离有机层和水层 |
| B.用图2所示装置从食盐水中提取NaCl |
| C.用图3所示装置用水来吸收HCl |
| D.用图4所示装置收集并检验氨气 |
某同学在实验报告中记录下列数据,正确的是 ( )
| A.用25ml量筒量取12.36 ml 盐酸 |
| B.用托盘天平称取8.75克食盐 |
| C.用标准NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10ml |
| D.用pH试纸测得某溶液的PH为3.5 |
下列仪器中,可用酒精灯直接加热的是
| A.烧杯 | B.烧瓶 | C.锥形瓶 | D.坩埚 |
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
(1)“酸浸”中硫酸要适当过量,目的是①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同),
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。
请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ;
b.沉淀: ;
c.分离,洗涤;
d.烘干,研磨。