题目内容
1.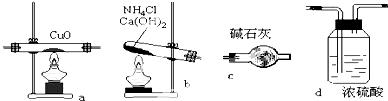 实验室用氨气在加热下还原氧化铜的方法铜的相对原子质量如果选用测定反应物氧化铜和生成物水的质量[m(CO)、m(H2O)]时,如图所示请用下列仪器设计一个简单实验方案.
实验室用氨气在加热下还原氧化铜的方法铜的相对原子质量如果选用测定反应物氧化铜和生成物水的质量[m(CO)、m(H2O)]时,如图所示请用下列仪器设计一个简单实验方案.(1)仪器连接的顺序(用字母编号表示,仪器可以重复使用)b c a c d;
(2)d 中浓硫酸的作用是吸收未反应的氨,防止空气中水分和二氧化碳进入装置c;a发生反应的化学方程式是2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O.
(2)列出计算铜的原子量的表达式$\frac{18m(CuO)}{m({H}_{2}O)}$-16.
(3)下列情况将使测得结果偏大的是AC(填编号)
A.CuO未全部还原为Cu B.CuO 受潮 C.CuO中混有Cu.
分析 根据本题的意图是需要测定反应物氧化铜和生成物水的质量,从而利用氨和加热条件下的氧化铜在化学反应中的关系求出铜的相对原子质量;CuO的质量可直接从所取的药品称量中得知,测反应生成的水的质量时,应考虑制得的氨气中混有的水蒸气对测量有干扰作用,应予以排除,反应后的气体中必然夹杂着未反应完的氨气,吸收水蒸气时也要考虑不能用浓硫酸作吸收剂,否则会同时吸入水蒸气和氨气,影响测定结果,
(1)按照制取氨气、干燥氨气、氨气与氧化铜加热反应、用浓硫酸测定上次水的质量的顺序连接装置;
(2)浓硫酸可以吸收多余的氨气,防止污染大气,还可以防止空气中水蒸气进入装置a,影响测定结果;氨气与氧化铜在加热条件下反应生成氮气、铜和水;
(3)根据反应方程式及水、氧化铜的质量列式找出出Cu的相对原子质量的表达式;
(4)要使测定结果偏大,则m(H2O)要偏小,据此对各选项进行判断.
解答 解:根据本题的意图是需要测定反应物氧化铜和生成物水的质量,从而利用氨和加热条件下的氧化铜在化学反应中的关系求出铜的相对原子质量;CuO的质量可直接从所取的药品称量中得知,测反应生成的水的质量时,应考虑制得的氨气中混有的水蒸气对测量有干扰作用,应予以排除,反应后的气体中必然夹杂着未反应完的氨气,吸收水蒸气时也要考虑不能用浓硫酸作吸收剂,否则会同时吸入水蒸气和氨气,造成测量数据偏大,
(1)NH4Cl和Ca(OH)2反应可生成NH3,经碱石灰干燥后(不能用浓H2SO4干燥,因为浓H2SO4要吸收NH3)把NH3通入a装置发生主体反应,将反应后生成的水蒸气用C吸收(不能用浓H2SO4吸收),因为还有未反应的NH3也可被浓H2SO4吸收,这样测量水的质量就偏大,多余的NH3用浓H2SO4吸收,同时也防止空气中的水蒸气进入第二个C装置中,所以装置连接顺序为:b c a c d;
故答案为:b c a c d;
(2)根据分析可知,浓硫酸可以吸收未反应的氨,还能够防止空气中水分和二氧化碳进入装置c;氨气与氧化铜发生氧化还原反应生成氮气、铜和水,反应的化学方程式为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O,
故答案为:吸收未反应的氨,防止空气中水分和二氧化碳进入装置c;2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O;
(3)设铜的相对原子质量为x,
2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O
3(x+16)3×18
m(CuO) m(H2O)
则:$\frac{m(CuO)}{m({H}_{2}O)}$=$\frac{3(x+16)}{3×18}$,
解得:x=$\frac{18m(CuO)}{m({H}_{2}O)}$-16,
故答案为:$\frac{18m(CuO)}{m({H}_{2}O)}$-16;
(4)要使测定结果偏大,则m(H2O)要偏小,
A.O未全部还原为Cu,导致m(H2O)偏小,测定结果偏大,故A正确;
B.CuO受潮,会导致m(H2O)偏大,测定结果偏小,故B错误;
C.CuO中混有Cu,氧元素含量减少,则生成水的质量偏小,导致测定结果偏大,故C正确;
故答案为:AC.
点评 本题考查了性质实验方案的设计与评价,题目难度中等,明确实验目的及反应原理为解答关键,试题有利于考查学生的分析、理解能力及化学实验、化学计算能力,是一道综合性较强的题目.

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案| A. | 把Cl2通入FeCl2溶液中 | |
| B. | 把一段打磨过的镁带放入少量冷水中 | |
| C. | 把绿豆大的钾投入少量水中 | |
| D. | 把溴水滴加到淀粉KI溶液中 |
①原子序数为15的元素的原子半径小于N原子半径
②第ⅦA族元素是同周期中非金属性最强的元素
③第二周期第ⅣA族元素的氢化物的稳定性大于NH3
④原子序数为12的元素的最高价氧化物对应水化物的碱性大于Al(OH)3.
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
| A. | NO可以是某些含低价氮物质的氧化产物 | |
| B. | NO可以是某些含高价氮物质的还原产物 | |
| C. | 已知亚硝酸钠的化学式是NaNO2,则NO不是亚硝酸酐 | |
| D. | NO2和NO都是红棕色气体 |
| A. | mg O2和mg O3 | B. | 7g N2和标准状况下5.6L CO2 | ||
| C. | 1mol氦气和标准状况下22.4L H2 | D. | 1mol SO2和22.4L H2S |
| A. | 3mL | B. | 10mL | C. | 15mL | D. | 27.5mL |
| A. | 用铂丝蘸取碳酸钾溶液,在火焰上灼烧时呈紫色 | |
| B. | 透过蓝色钴玻璃观察火焰呈紫色,说明该溶液中只含K+ | |
| C. | 现代化学分析测试中常用到元素分析仪、红外光谱仪、原子吸收光谱等 | |
| D. | 焰色反应是化学变化 |
| A. | 铷的金属活动性不如镁强,故镁可置换铷 | |
| B. | 铷的沸点比镁低,把铷蒸气抽出时,平衡右移 | |
| C. | MgCl2的热稳定性不如Rb强 | |
| D. | 铷的单质状态较化合态更稳定 |