题目内容
19.锌-空气电池是一种新型的高校电池,其荷电量一般比同体积的锌锰电池大3倍以上.在碱性环境下,其总反应方程式为2Zn+2NaOH+O2=2NaHZnO2.下列说法正确的是( )| A. | 该电池的负极反应方程式为Zn-2e-+3OH-=HZnO2-+H2O | |
| B. | 当负极减重65g时,正极消耗O2的体积为11.2L | |
| C. | 电池在放电过程中阳离子移向负极,阴离子移向正极 | |
| D. | 随着放电过程进行,电池正极区域附近pH减小 |
分析 A、总反应的离子方程式为2Zn+2OH-+O2=2HZnO2-,在碱性环境下,正极反应式为:O2+2H2O+4e-=4OH-,总反应式-正极反应式=负极反应式,因此负极反应式为Zn-2e-+3OH-=HZnO2-+H2O;
B、65gZn的物质的量为1mol,根据2Zn+2NaOH+O2=2NaHZnO2计算氧气的物质的量为0.5mol,0.5mol氧气的体积与所处的温度和压强有关,因此体积不一定是11.2L;
C、根据异性相吸,电池在放电过程中阳离子移向正极,阴离子移向负极;
D、根据正极电极反应式O2+2H2O+4e-=4OH-判断.
解答 解:A、总反应的离子方程式为2Zn+2OH-+O2=2HZnO2-,在碱性环境下,正极反应式为:O2+2H2O+4e-=4OH-,总反应式-正极反应式=负极反应式,因此负极反应式为Zn-2e-+3OH-=HZnO2-+H2O,故A正确;
B、65gZn的物质的量为1mol,根据2Zn+2NaOH+O2=2NaHZnO2计算氧气的物质的量为0.5mol,0.5mol氧气的体积与所处的温度和压强有关,因此体积不一定是11.2L,故B错误;
C、根据异性相吸,电池在放电过程中阳离子移向正极,阴离子移向负极,故C错误;
D、该电池的正极反应式O2+2H2O+4e-=4OH-,电池正极区域附近OH-浓度增大,pH减大,故D错误;
故选A.
点评 本题考查了原电池原理,侧重于新型化学电池电极反应式的书写和有关计算,难度中等,书写电极反应式时可根据①负氧化、正还原②总反应式-正极反应式=负极反应式③三个守恒:元素守恒、电子守恒、电荷守恒④电解质溶液的影响分析判断.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
9.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
| A. | 原混合溶液中c(K+)为4 mol•L-1 | |
| B. | 上述电解过程中共转移4 mol电子 | |
| C. | 电解得到的Cu的物质的量为0.5 mol | |
| D. | 电解后溶液中c(H+)为2 mol•L-1 |
10.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 沸点高的物质制备沸点低的物质 | 钙置换出铷,或浓磷酸制备HI |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | BCl3沸点低于AlCl3,CO2沸点低于SiO2 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
| A. | A | B. | B | C. | C | D. | D |
7.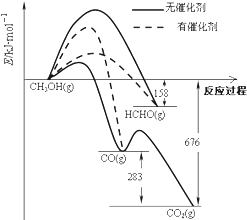 如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )
如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )
 如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )
如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )| A. | 未使用催化剂,氧化产物有三种 | |
| B. | 使用催化剂,氧化产物主要是CO或者HCHO | |
| C. | CH3OH的燃烧热大于676kJ•mol-1 | |
| D. | 2HCHO(g)+O2=2CO(g)+2H2O(g)△H=-470kJ•mol-1 |
14.有机物命名正确的是( )
| A. |  1,3,4-三甲苯 | B. |  2-甲基-1-丙醇 | C. |  2-甲基-2-氯丙烷 | D. |  2-甲基-3-丁炔 |
4.下表是三种难溶物质的有关数据
关于25℃时等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液,下列说法正确的是( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.0 | ≥6.7 | ≥3.2 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到白色沉淀 | |
| B. | PH=10时溶液中c(Cu2+):c(Fe2+:c(Fe3+)=(2.2×10-20):(8.0×10-16 ):( 4.0×10-34 ) | |
| C. | 该溶液中2c(SO42-)=2c(Cu2+)+2c(Fe2+)+3c(Fe3+) | |
| D. | 通入氨气将该溶液的PH调节到9后所得沉淀经过过滤、洗涤、干燥、灼烧,可得三种金属氧化物 |
11.下列物质在指定条件下电离方程式正确的是( )
| A. | Na2CO3溶于水 Na2CO3═Na22++CO32- | |
| B. | Al(OH)3酸式电离 Al(OH)3═H++AlO2-+H2O | |
| C. | NaHS溶于水HS-的电离 HS-+H2O?H2S+OH- | |
| D. | NaHCO3在水溶液中电离 NaHCO3═Na++HCO3- |
8.已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol•L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应为( )
| A. | 2.8×10-2 mol•L-1 | B. | 1.4×10-5 mol•L-1 | ||
| C. | 2.8×10-5 mol•L-1 | D. | 5.6×10-5 mol•L-1 |
13.某化学兴趣小组在一次实验活动中发现钠能在二氧化碳中燃烧,他们对钠在二氧化碳气体中燃烧后生成的白色物质进行了如下探究:
实验:将燃烧的钠迅速伸入到盛满二氧化碳的集气瓶中,钠在其中继续燃烧至完全,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质.
查资料:Na2O+H2O=2NaOH
提出假设:燃烧后瓶璧上附着的白色物质是什么?
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3
假设3:白色物质可能是Na2O和Na2CO3的混合物.
设计实验方案,验证假设
思考与交流:
(1)甲同学认为方案1得到的结论不正确,其理由是Na2CO3的水溶液显碱性,遇酚酞变红色
(2)根据方案2的结论,补齐方案2中②的实验操作,并写出相应的实验现象.
实验操作:滴加酚酞试液 实验现象:溶液颜色没有变化(上层清液是NaCl显中性)
(3)乙同学认为白色物质可能是NaOH,你填不同意(同意或不同意)该同学的观点,并简述理由:反应物中无氢元素,违背质量守恒定律
(4)根据假设2,写出钠在二氧化碳中燃烧的化学方程式:4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.
实验:将燃烧的钠迅速伸入到盛满二氧化碳的集气瓶中,钠在其中继续燃烧至完全,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质.
查资料:Na2O+H2O=2NaOH
提出假设:燃烧后瓶璧上附着的白色物质是什么?
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3
假设3:白色物质可能是Na2O和Na2CO3的混合物.
设计实验方案,验证假设
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质是Na2O. |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入适量BaCl2 | 有白色沉淀生成 | 白色物质是Na2CO3 |
| ②静置片刻,取上层清液于试管中… | …. |
(1)甲同学认为方案1得到的结论不正确,其理由是Na2CO3的水溶液显碱性,遇酚酞变红色
(2)根据方案2的结论,补齐方案2中②的实验操作,并写出相应的实验现象.
实验操作:滴加酚酞试液 实验现象:溶液颜色没有变化(上层清液是NaCl显中性)
(3)乙同学认为白色物质可能是NaOH,你填不同意(同意或不同意)该同学的观点,并简述理由:反应物中无氢元素,违背质量守恒定律
(4)根据假设2,写出钠在二氧化碳中燃烧的化学方程式:4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.