题目内容
8.已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol•L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应为( )| A. | 2.8×10-2 mol•L-1 | B. | 1.4×10-5 mol•L-1 | ||
| C. | 2.8×10-5 mol•L-1 | D. | 5.6×10-5 mol•L-1 |
分析 Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
解答 解:Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=$\frac{1}{2}$×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=$\frac{2.8×1{0}^{-9}}{1×1{0}^{-4}}$mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L.
故选D.
点评 本题考查溶度积的有关计算,难度中等,注意计算时容易忽略混合后溶液的浓度发生变化.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
18.下列关于苯酚的叙述中,错误的是( )
| A. | 其水溶液显酸性,俗称石碳酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 碳酸氢钠溶液中滴入苯酚的水溶液后立即放出二氧化碳 |
19.锌-空气电池是一种新型的高校电池,其荷电量一般比同体积的锌锰电池大3倍以上.在碱性环境下,其总反应方程式为2Zn+2NaOH+O2=2NaHZnO2.下列说法正确的是( )
| A. | 该电池的负极反应方程式为Zn-2e-+3OH-=HZnO2-+H2O | |
| B. | 当负极减重65g时,正极消耗O2的体积为11.2L | |
| C. | 电池在放电过程中阳离子移向负极,阴离子移向正极 | |
| D. | 随着放电过程进行,电池正极区域附近pH减小 |
16.下列物质不能用于萃取溴水中溴的是( )
| A. | 直馏汽油 | B. | 裂化汽油 | C. | 酒精 | D. | 己烷 |
1. 浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
 浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )| A. | 实验开始时需给a试管稍微加热 | |
| B. | 反应开始时铜片表面可以看到有黑色物质生成 | |
| C. | 将a试管里的溶液冷却后注入盛有水的烧杯中,溶液呈蓝色 | |
| D. | b试管中的溶液逐渐褪为无色,说明反应生成的气体,将品红氧化为无色 |
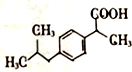
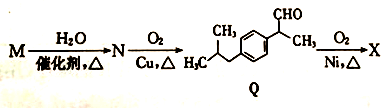
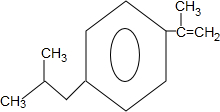 +H2O$→_{△}^{催化剂}$
+H2O$→_{△}^{催化剂}$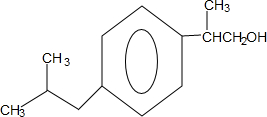 .
. 或
或 .
.