题目内容
11.下列物质在指定条件下电离方程式正确的是( )| A. | Na2CO3溶于水 Na2CO3═Na22++CO32- | |
| B. | Al(OH)3酸式电离 Al(OH)3═H++AlO2-+H2O | |
| C. | NaHS溶于水HS-的电离 HS-+H2O?H2S+OH- | |
| D. | NaHCO3在水溶液中电离 NaHCO3═Na++HCO3- |
分析 A.钠离子符号书写错误;
B.氢氧化铝为弱电解质,部分电离用可逆号;
C.硫氢根离子为弱酸的酸式根离子,电离生成硫离子和氢离子;
D.碳酸氢钠为强电解质,完全电离出钠离子和碳酸氢根离子;
解答 解:A.Na2CO3溶于水完全电离,电离方程式:Na2CO3═2Na++CO32-,故A错误;
B.Al(OH)3酸式电离,电离方程式:Al(OH)3 ?H++AlO2-+H2O,故B错误;
C.NaHS溶于水HS-的电离的方程式为:HS-?S2-+H+,故C错误;
D.NaHCO3为强电解质,完全电离出钠离子和碳酸氢根离子,电离方程式:NaHCO3═Na++HCO3-,故D正确;
故选:D.
点评 本题考查了离子方程式书写,侧重考查盐类的水解和电解质的电离,熟悉电解质的强弱、盐类水解规律是解题关键,题目难度不大.

练习册系列答案
相关题目
1.在空气中直接蒸发下列盐的溶液:①Al2(SO4)3;②Na2CO3;③KCl;④CuCl2;⑤NaHCO3,可以得到相应盐的晶体(可以含有结晶水)的是( )
| A. | ①③⑤ | B. | ①②③ | C. | ②④ | D. | ①③④⑤ |
2.类推的思维方式在化学学习与研究中经常采用,但类推得出的结论是否正确最终要经过实践的验证.以下类推的结论正确的是( )
| A. | 由Cl2+H2O=HCl+HClO可推出F2+H2O=HF+HFO | |
| B. | HCl的水溶液是强酸,推出HF水溶液也是强酸 | |
| C. | 由2Fe+3Cl2=2FeCl3可推出2Fe+3I2=2FeI3 | |
| D. | Na、K在属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应 |
19.锌-空气电池是一种新型的高校电池,其荷电量一般比同体积的锌锰电池大3倍以上.在碱性环境下,其总反应方程式为2Zn+2NaOH+O2=2NaHZnO2.下列说法正确的是( )
| A. | 该电池的负极反应方程式为Zn-2e-+3OH-=HZnO2-+H2O | |
| B. | 当负极减重65g时,正极消耗O2的体积为11.2L | |
| C. | 电池在放电过程中阳离子移向负极,阴离子移向正极 | |
| D. | 随着放电过程进行,电池正极区域附近pH减小 |
6.在下列给出的已知溶液中能大量共存的离子是( )
| 选项 | 已知溶液 | 大量存在的离子 |
| A | NH4HCO3溶液 | K+、Na+、NO3-、Cl- |
| B | FeCl3溶液 | Fe2+、NH4+、SCN-、SO42- |
| C | 中性溶液 | Cu2+、K+、Cl-、SO42- |
| D | CH3COOH溶液 | NH4+、Na+、SO42-、CO32- |
| A. | A | B. | B | C. | C | D. | D |
16.下列物质不能用于萃取溴水中溴的是( )
| A. | 直馏汽油 | B. | 裂化汽油 | C. | 酒精 | D. | 己烷 |
5.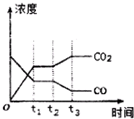 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反
应:CO (g)+H2O(g)?CO2(g)+H2(g),△H<0
800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0.
①从起始经过5min达到化学平衡时,用生成物CO2表示该反应的反应速率v(CO2)=0.01mol/(L•min);平衡时,容器中CO的转化率为50%.
②如图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是降低温度或降低H2浓度或增大H2O(g)浓度.(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:
CO(g)+l/2O2(g)?CO2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请在表中的空格处填写“>““<”或“=“.
②相同温度下,某汽车尾气中CO、CO2的浓度分别为l.0×10-5mol/L和1.0×l0-4mol/L.若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×l0-4mol/L,则最终尾气中CO的浓度为1.1×10-6mol/L(请保留两位有效数字).
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反
应:CO (g)+H2O(g)?CO2(g)+H2(g),△H<0
800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0.
| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
②如图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是降低温度或降低H2浓度或增大H2O(g)浓度.(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:
CO(g)+l/2O2(g)?CO2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请在表中的空格处填写“>““<”或“=“.
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
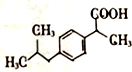
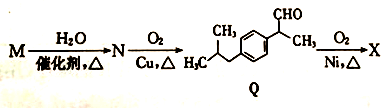
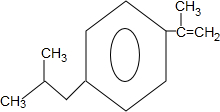 +H2O$→_{△}^{催化剂}$
+H2O$→_{△}^{催化剂}$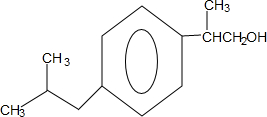 .
. 或
或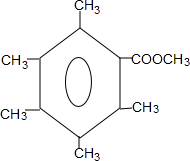 .
.