题目内容
4.下表是三种难溶物质的有关数据| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.0 | ≥6.7 | ≥3.2 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到白色沉淀 | |
| B. | PH=10时溶液中c(Cu2+):c(Fe2+:c(Fe3+)=(2.2×10-20):(8.0×10-16 ):( 4.0×10-34 ) | |
| C. | 该溶液中2c(SO42-)=2c(Cu2+)+2c(Fe2+)+3c(Fe3+) | |
| D. | 通入氨气将该溶液的PH调节到9后所得沉淀经过过滤、洗涤、干燥、灼烧,可得三种金属氧化物 |
分析 A.根据表中数据可知,加入氢氧化钠时pH越小的越易生成沉淀;
B.依据Ksp计算出当pH=10时溶液中c(Cu2+)、c(Fe2+)和c(Fe3+);
C.溶液呈电中性,根据电荷守恒判断;
D.沉淀中含有Cu(OH)2、Fe(OH)2和Fe(OH)3,对沉淀灼烧后氢氧化亚铁变成氢氧化铁,最终得到的是氧化铁和氧化铜的混合物.
解答 解:A.根据反应的先后顺序,Ksp越小,越容易反应产生沉淀,故最先产生的沉淀是Fe(OH)3,应该最先看到红褐色沉淀,故A错误;
B.PH=10时溶液中溶液中c(OH-)=10-4mol/L,c(Cu2+):c(Fe2+:c(Fe3+)=$\frac{2.2×1{0}^{-20}}{(1{0}^{-4})^{2}}$:$\frac{8.0×1{0}^{-16}}{(1{0}^{-4})^{2}}$:$\frac{4.0×1{0}^{-38}}{(1{0}^{-4})^{3}}$=(2.2×10-20):(8.0×10-16 ):(4.0×10-34 ),故B正确;
C.由电荷守恒可知溶液中存在2c(SO42-)+c(OH-)=2c(Cu2+)+2c(Fe2+)+3c(Fe3+)+c(H+),因盐类水解呈酸性,则c(H+)>c(OH-),则2c(SO42-)>2c(Cu2+)+2c(Fe2+)+3c(Fe3+),故C错误;
D.由表中数据知,在pH到9.6后过滤,沉淀中含有Cu(OH)2、Fe(OH)2和Fe(OH)3,对沉淀灼烧,最终得到的是CuO和Fe2O3两种固体的混合物,故D错误;
故选B.
点评 本题考查难溶电解质的溶解平衡以及转化等知识,为高频考点,侧重于学生的分析、计算能力的考查,题目难度中等,注意溶度积的计算公式的运用.

练习册系列答案
相关题目
15.A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
(1)写出A、B、C三种元素的名称N、S、F;
(2)B位于元素周期表中第三周期,第ⅥA族;
(3)C的原子结构示意图为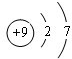 ,比较B、C的原子半径:B>C;
,比较B、C的原子半径:B>C;
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
| A | C | |
| B |
(2)B位于元素周期表中第三周期,第ⅥA族;
(3)C的原子结构示意图为
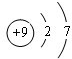 ,比较B、C的原子半径:B>C;
,比较B、C的原子半径:B>C;(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
12.在锌铜原电池中,当导线中有1mole-通过时,从理论上分析,两极的变化是( )
①锌片溶解了32.5g ②锌片增重了32.5g
③铜片上析出1g氢气 ④铜片上析出1mol氢气.
①锌片溶解了32.5g ②锌片增重了32.5g
③铜片上析出1g氢气 ④铜片上析出1mol氢气.
| A. | ①和③ | B. | ①和④ | C. | ②和③ | D. | ②和④ |
19.锌-空气电池是一种新型的高校电池,其荷电量一般比同体积的锌锰电池大3倍以上.在碱性环境下,其总反应方程式为2Zn+2NaOH+O2=2NaHZnO2.下列说法正确的是( )
| A. | 该电池的负极反应方程式为Zn-2e-+3OH-=HZnO2-+H2O | |
| B. | 当负极减重65g时,正极消耗O2的体积为11.2L | |
| C. | 电池在放电过程中阳离子移向负极,阴离子移向正极 | |
| D. | 随着放电过程进行,电池正极区域附近pH减小 |
9.将某溶液逐滴加入Al(OH)3溶胶内,开始产生沉淀,继续滴加时沉淀又溶解,该溶液是( )
| A. | 2 mol/L NaOH的溶液 | B. | 2 mol/L Na2SO4的溶液 | ||
| C. | 2 mol/L MgSO4的溶液 | D. | FeCl3溶液 |
16.下列物质不能用于萃取溴水中溴的是( )
| A. | 直馏汽油 | B. | 裂化汽油 | C. | 酒精 | D. | 己烷 |
18.臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)?N2O5(g)+O2(g),在T温度下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列有关说法正确的是( )
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3 s内的平均速率v(NO2)=0.24 mol•L-1•s-1 | |
| B. | 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20% |
 6
6 7
7 6
6 6.
6.