题目内容
15.二氧化氯是黄绿色的气体,可用于水体消毒与废水处理.一种制备方法为:1 H2C2O4+2NaClO3+1H2SO4→1 Na2SO4+2CO2↑+2 ClO2↑+2 H2O,完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是ClO2.
(2)该反应每产生0.2mol ClO2,需要消耗草酸晶体(H2C2O4•2H2O)12.6 g.
(3)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与HClO相同.(写一种)
(4)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式2ClO2+2CN-=2CO2+N2+2Cl-.
(5)上述反应产物NaCl中含有离子键,工业上用电解熔融的氯化钠制备金属钠,氯气在阳极
(写电极名称)产生.
分析 (1)分析反应中各元素化合价变化,找出化合价升高和降低的元素,依据氧化还原反应得失电子守恒结合原子个数守恒规律配平方程式;所含元素化合价降低的反应物为氧化剂,对应产物为还原产物;
(2)依据方程式1H2C2O4+2NaClO3+1H2SO4→1Na2SO4+2CO2↑+2ClO2↑+2H2O,生成2molCO2,消耗H2C2O4;
据此计算每产生0.2mol ClO2,需要消耗草酸晶体(H2C2O4•2H2O)的物质的量,依据m=nM计算其质量;
(3)二氧化氯、次氯酸都具有强的氧化性,都能够氧化有机色素生成无色物质;
(4)根据信息:二氧化氯和氰化钠(NaCN)反应,生成NaCl、CO2和N2,配平方程式即可;
(5)氯化钠为钠离子与氯离子通过离子键结合在一起;工业上用电解熔融的氯化钠制备金属钠,阳极发生氧化反应,阴极发生还原反应,据此解答.
解答 解:(1)反应中H2C2O4中C元素的化合价从+3升高到了CO2中+4价,共失电子2mol,NaClO3中Cl元素的化合价从+5价降到了ClO2中+4价,共得到电子1mol,依据氧化还原反应得失电子守恒,H2C2O4系数为1,NaClO3系数为2,结合原子个数守恒规律,可知反应方程式:1H2C2O4+2NaClO3+1H2SO4→1Na2SO4+2CO2↑+2ClO2↑+2H2O;
NaClO3中Cl元素的化合价从+5价降到了ClO2中+4价,做氧化剂,对应产物ClO2为还原产物;
故答案为:1;2;1;1;2;2;2;ClO2;
(2)依据方程式1H2C2O4+2NaClO3+1H2SO4→1Na2SO4+2CO2↑+2ClO2↑+2H2O,生成2molCO2,消耗H2C2O4;
所以计算每产生0.2mol ClO2,消耗0.1molH2C2O4,需要消耗草酸晶体(H2C2O4•2H2O)质量m=0.1mol×126g/mol=12.6g;
故答案为:12.6;
(3)二氧化氯、次氯酸都具有强的氧化性,都能够氧化有机色素生成无色物质;
故答案为:HClO;
(4)根据信息:二氧化氯和氰化钠(NaCN)反应,生成NaCl、CO2和N2,即2ClO2+2CN-=2CO2+N2+2Cl-,故答案为:2ClO2+2CN-=2CO2+N2+2Cl-;
(5)氯化钠为钠离子与氯离子通过离子键结合在一起;工业上用电解熔融的氯化钠制备金属钠,阳极氯离子失去电子发生氧化反应生成氯气,阴极钠离子得到电子发生还原反应生成钠,
故答案为:离子; 阳极.
点评 本题为综合题,考查了氧化还原方程式配平、电子转移数目计算、物质漂白性的原理、钠的冶炼,明确氧化还原反应规律、熟悉电解池工作原理是解题关键,题目难度中等.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案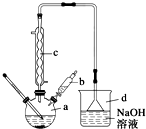 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率.
(3)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2 (填化学式).
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
| A. | 含有 NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,44g CO2中含有的分子数为NA | |
| C. | 在常温常压下,22.4L Cl2含有的分子数为1.0NA | |
| D. | 在标准状况下,22.4L H2O含有的分子数为1.0NA |
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO42-和Ag+ | D. | 可能含有SO42-或Ag+ |
| A. | 向NH4Al(S04)2溶液中滴加过量Ba(OH)2溶液:2Ba2++40H-+2S042-+Al3+=2BaS04↓+2H20+Al02- | |
| B. | 向NaHS04溶液中滴Ba(OH)2溶液至S042-完全沉淀:2 H++S042-+Ba2++20H-=BaS04↓+2H20 | |
| C. | 向0.1mol.L-l、pH=l的NaHA溶液中加入NaOH溶液:HA-十OH-=A2-+H20 | |
| D. | 向1L lmol.L-1的FeBr2溶液中通等物质的量Cl2:2Cl2+2Fe2++2Br-=4Cl-十2Fe3++Br2 |
①制备乙酸乙酯时,将乙酸乙酯蒸气通入饱和Na2CO3溶液的导管
②制备氯气装置中的分液漏斗
③制备氨水时将氨气溶于水的导管
④制备氢气的简易装置中加入稀硫酸用的长颈漏斗
⑤分馏石油时的温度计.
| A. | ①②④ | B. | ④ | C. | ①②③ | D. | ②③④ |
| A. | 等质量的Na2CO3、NaHCO3与足量的盐酸反应,在相同条件下NaHCO3产生CO2的体积大 | |
| B. | 等物质的量的Na2CO3和NaHCO3与同浓度的足量盐酸反应,Na2CO3所消耗盐酸的体积是NaHCO3的两倍 | |
| C. | 将石灰水加入NaHCO3溶液中不会产生沉淀,加入Na2CO3溶液中会产生沉淀 | |
| D. | 等物质的量的NaHCO3和Na2CO3与足量Ba(OH)2溶液反应,所得沉淀的质量相等 |