题目内容
5.下列有关碳酸钠和碳酸氢钠的性质的叙述中,错误的是( )| A. | 等质量的Na2CO3、NaHCO3与足量的盐酸反应,在相同条件下NaHCO3产生CO2的体积大 | |
| B. | 等物质的量的Na2CO3和NaHCO3与同浓度的足量盐酸反应,Na2CO3所消耗盐酸的体积是NaHCO3的两倍 | |
| C. | 将石灰水加入NaHCO3溶液中不会产生沉淀,加入Na2CO3溶液中会产生沉淀 | |
| D. | 等物质的量的NaHCO3和Na2CO3与足量Ba(OH)2溶液反应,所得沉淀的质量相等 |
分析 A.等质量的Na2CO3和NaHCO3,NaHCO3物质的量较多,生成二氧化碳多;
B.等物质的量的Na2CO3和NaHCO3,Na2CO3中的钠离子是NaHCO3中的钠离子两倍;
C.Na2CO3和NaHCO3都与澄清的石灰水反应生成沉淀;
D.Na2CO3和NaHCO3都与Ba(OH)2溶液反应生成沉淀,方程式为:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH和NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O.
解答 解:A.等质量的Na2CO3和NaHCO3,NaHCO3物质的量较多,生成二氧化碳多,故A正确;
B.等物质的量的Na2CO3和NaHCO3,Na2CO3中的钠离子是NaHCO3中的钠离子两倍,所根据钠、氯原子守恒,则Na2CO3所消耗盐酸的体积是NaHCO3的两倍,故B正确;
C.Na2CO3和NaHCO3都与澄清的石灰水反应生成沉淀,反应为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH和NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,故C错误;
D.Na2CO3和NaHCO3都与Ba(OH)2溶液反应生成沉淀,方程式为:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH和NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O,所以等物质的量的NaHCO3和Na2CO3与足量Ba(OH)2溶液反应,所得沉淀的质量相等,故D正确.
故选C.
点评 本题考查Na2CO3和NaHCO3性质的异同,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.

练习册系列答案
相关题目
16.0.5mol H2SO4的质量( )
| A. | 98g | B. | 49g | C. | 80g | D. | 32g |
13.下列仪器:①试管;②量筒;③烧杯;④蒸发皿;⑤冷凝管;⑥坩锅;⑦圆底烧瓶;⑧锥形瓶,能用酒精灯加热,但加热时需要垫石棉网的是( )
| A. | ①③⑦ | B. | ③④⑦ | C. | ③⑦⑧ | D. | ③⑥⑧ |
20.对下列实验的描述不正确的是( )
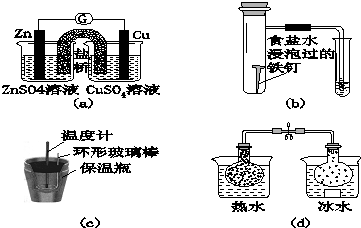

| A. | 图(a)所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性 | |
| B. | 图(b)所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 | |
| C. | 图(c)所示的实验:根据温度计读数的变化用稀盐酸和稀NaOH溶液反应测定中和热 | |
| D. | 图(d)所示的实验:根据两烧瓶中气体颜色的变化判断2NO2(g)?N2O4(g)是放热反应 |
10.下列化学用语表述正确的是( )
| A. | 水分子的结构式: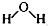 | B. | 氯化钠的电子式: | ||
| C. | 氯气的比例模型: | D. | 硫原子的结构示意图: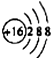 |
17.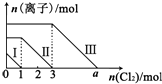 向仅含Fe2+、I-、Br -的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+、I-、Br -的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示.下列说法中正确的是( )
 向仅含Fe2+、I-、Br -的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+、I-、Br -的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示.下列说法中正确的是( )| A. | 线段Ⅲ代表Fe2+的变化情况 | B. | 线段Ⅰ代表Br -的变化情况 | ||
| C. | 原混合溶液中n(FeBr2)=4mol | D. | a数值等于6 |