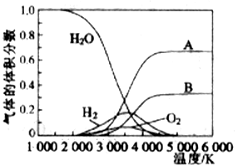
题目内容
10.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 含有 NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,44g CO2中含有的分子数为NA | |
| C. | 在常温常压下,22.4L Cl2含有的分子数为1.0NA | |
| D. | 在标准状况下,22.4L H2O含有的分子数为1.0NA |
分析 A、氦气为单原子分子;
B、分子个数N=$\frac{m}{M}{N}_{A}$;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、标况下水为液态.
解答 解:A、氦气为单原子分子,故NA个氦原子即NA个氦气分子,即为1mol氦气,在标况下下体积为22.4L,故A错误;
B、分子个数N=$\frac{m}{M}{N}_{A}$=$\frac{44g}{44g/mol}{N}_{A}$=NA个,故B正确;
C、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L氯气的物质的量小于1mol,则分子个数小于NA个,故C错误;
D、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
20.对下列实验的描述不正确的是( )
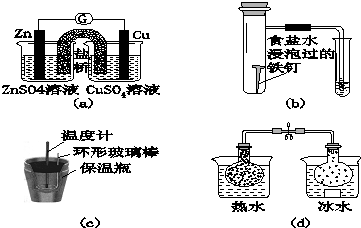

| A. | 图(a)所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性 | |
| B. | 图(b)所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 | |
| C. | 图(c)所示的实验:根据温度计读数的变化用稀盐酸和稀NaOH溶液反应测定中和热 | |
| D. | 图(d)所示的实验:根据两烧瓶中气体颜色的变化判断2NO2(g)?N2O4(g)是放热反应 |
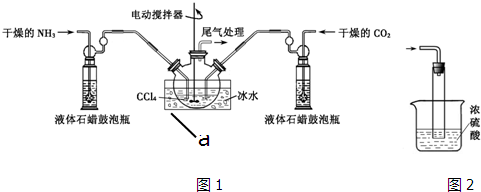
 一学习小组利用如图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.
一学习小组利用如图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.