题目内容
【题目】用下列装置进行实验能达到相应实验目的的是
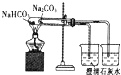
A.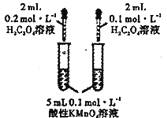 装置探究浓度对化学反应速率的影响
装置探究浓度对化学反应速率的影响
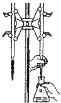
B.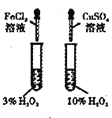 装置探究催化剂对H2O2分解速率的影响
装置探究催化剂对H2O2分解速率的影响
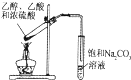
C.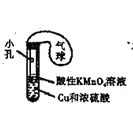 装置制取SO2气体并验证其还原性(可加热)
装置制取SO2气体并验证其还原性(可加热)
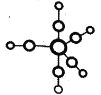
D.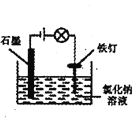 装置防止铁钉生锈
装置防止铁钉生锈
【答案】C
【解析】
A. 该实验中高锰酸钾溶液过量,不能褪色,因此无法记录褪色的时间,因此该装置不能探究浓度对化学反应速率的影响,A项错误;
B. 欲探究催化剂对H2O2分解速率的影响,应保证过氧化氢的浓度是一致的,B项错误;
C. 加热条件下,浓硫酸和铜发生氧化还原反应生成二氧化硫气体,二氧化硫具有还原性,可与酸性高锰酸钾发生氧化还原反应,使酸性高锰酸钾溶液褪色,故C正确;
D. 该装置为电解池,Fe作阳极,加速被腐蚀,不能防止铁钉生锈,故D错误;
答案选C。

练习册系列答案
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
【题目】下列解释实验事实的化学用语不正确的是( )
实验 | 解释 | |
A | 25℃0.1mol/L盐酸溶液pH=1 | H2O=H++OH- |
B | 25℃0.1mol/L的NH3·H2OpH=11 | NH3·H2O |
C | 配制FeCl3溶液时加少量盐酸 | Fe3++3H2O |
D | 向0.1mol/LNa2CO3溶液中滴加酚酞试液后溶液变红 | CO32-+H2O |
A.AB.BC.CD.D
【题目】在如图所示装置中,观察到电流计指针偏转,M棒变细,N棒变粗,其中P为电解质溶液。由此判断M、N、P所代表的物质不可能是( )
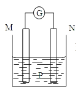
M | N | P | |
A | Zn | Cu | 稀硫酸 |
B | Fe | Cu | 硫酸铜溶液 |
C | Zn | Ag | 硝酸银溶液 |
D | Zn | Fe | 硝酸铜溶液 |
A.AB.BC.CD.D