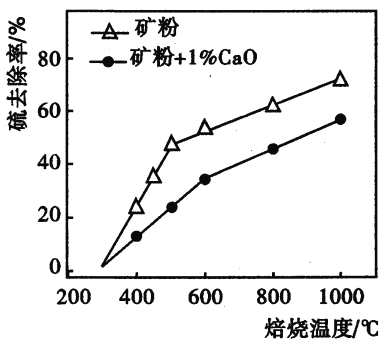
题目内容
【题目】(10分)H2S在水中的电离方程式为 。
(1)向H2S溶液中加入浓盐酸时,电离平衡向 (填左、右、不)移动,c(H+) (填增大、减小、不变),c(S2-) (填增大、减小、不变)。
(2)向H2S溶液中加入NaOH固体,电离平衡向 (填左、右、不)移动,c(H+) (填增大、减小、不变),c(S2-) (填增大、减小、不变)。
(3)若要使H2S溶液中c(HS-)增大,且使H2S的电离平衡逆向移动,可以加入 。
(4)向H2S溶液中加水,c(HS-) (填增大、减小、不变),溶液pH (填增大、减小、不变)
【答案】(10分)
H2S![]() H++HS-,HS-
H++HS-,HS-![]() H++S2- (1分)
H++S2- (1分)
(1)左,增大,减小 (每空1分) (2)右,减小,增大(每空1分)
(3)NaHS固体 (1分) (4)减小,增大(每空1分)
【解析】
试题 H2S为二元弱酸,分步电离,所以电离方程式为:H2S![]() H++HS-,HS-
H++HS-,HS-![]() H++S2-
H++S2-
(1)向H2S溶液中加入浓盐酸,增加了H+浓度,使电离平衡向左移动,c(S2)减小。
(2)向H2S溶液中加入NaOH固体,OH与H+反应,H+浓度减小,电离平衡向右移动,c(S2)增大。
(3)要使H2S溶液中c(HS-)增大,且使H2S的电离平衡逆向移动,应加入能溶于水的含HS的盐,所以为NaHS固体等。
(4)加水稀释可使弱电解质的电离平衡向右移动,因为溶液的体积变大,所以c(HS-)减小,c(H+)减小,故pH增大。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】在100℃时,将0.1mol的四氧化二氮气体充入1 L抽空的密闭容器中,发生反应,隔一定时间对该容器内的物质进行分析,得到如下数据:
浓度 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L—1 | 0.1 | c1 | 0.05 | c3 | a | b |
c(NO2)/mol·L—1 | 0 | 0.06 | c2 | 0.12 | 0.12 | 0.12 |
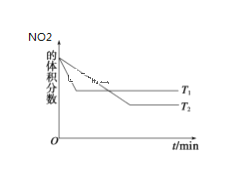
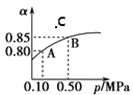
(1)该反应的化学方程式为______________________,表中c2_____c3_____a______b(选填“>”、“<”、“==”)。
(2)20 s时四氧化二氮的浓度c1=____________mol·l—1依据图象可以判断该反应的 ΔH___0(填“>”或“<”)
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、量筒、0.5mol·L-1盐酸、0.55mol·L-1NaOH溶液,实验尚缺少的玻璃用品是__。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒__(填“能”或“否”),其原因是__。
(3)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50mL0.55mol·L-1NaOH溶液 | 50mL0.5mol·L-1溶液 | 20℃ | 23.3℃ | |
② | 50mL0.55mol·L-1NaOH溶液 | 50mL0.5mol·L-1HCl溶液 | 20℃ | 23.5℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ·℃-1·kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。___
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:__。