题目内容
【题目】下列解释实验事实的化学用语不正确的是( )
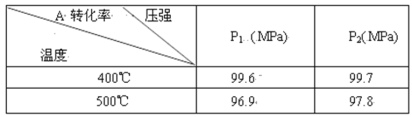
实验 | 解释 | |
A | 25℃0.1mol/L盐酸溶液pH=1 | H2O=H++OH- |
B | 25℃0.1mol/L的NH3·H2OpH=11 | NH3·H2O |
C | 配制FeCl3溶液时加少量盐酸 | Fe3++3H2O |
D | 向0.1mol/LNa2CO3溶液中滴加酚酞试液后溶液变红 | CO32-+H2O |
A.AB.BC.CD.D
【答案】A
【解析】
A.25℃0.1mol/L盐酸溶液pH=1,是因为HCl=H++Cl-,与水的电离无关,A错误;
B.25℃0.1mol/L的NH3·H2OpH=11,c(OH-)< c(NH3·H2O),是因为NH3·H2O![]() NH4+ + OH-,B正确;
NH4+ + OH-,B正确;
C.配制FeCl3溶液时,由于Fe3++3H2O![]() Fe(OH)3+3H+,为抑制Fe3+水解,加少量盐酸,C正确;
Fe(OH)3+3H+,为抑制Fe3+水解,加少量盐酸,C正确;
D.0.1mol/LNa2CO3溶液中,由于CO32-+H2O![]() HCO3-+OH-,所以滴加酚酞试液后溶液变红,D正确。
HCO3-+OH-,所以滴加酚酞试液后溶液变红,D正确。
故选A。

 口算能手系列答案
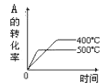
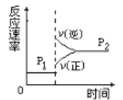
口算能手系列答案【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.40 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是( )
A.根据实验①、②可以推测该反应正反应△H>0
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
【题目】甲醇是重要的化工原料。在催化剂的作用下,利用合成气(主要成分为CO、CO2和H2)合成甲醇的主要化学反应如下:
Ⅰ.CO+2H2![]() CH3OH
CH3OH
Ⅱ.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
Ⅲ.CO2+H2![]() CO+H2O
CO+H2O
请回答下列问题:
(1)已知三种物质的标准燃烧热如下表:
物质 | CO(g) | H2(g) | CH3OH(l) |
燃烧热(kJ·mol1) | 283.0 | 285.8 | 726.5 |
①书写25℃、101kPa条件时CO燃烧热的热化学方程式____________。
②计算25℃、101kPa条件时反应Ⅰ的ΔH=_____kJ·mol1 。
(2)甲醇燃料电池(Direct Methanol Fuel Cell)属于质子交换膜燃料电池,其工作原理如图所示:
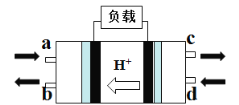
①c处产生的气体是_______________;
②负极的电极反应式是_______________。
(3)下图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A,B两极上产生的气体体积相同。
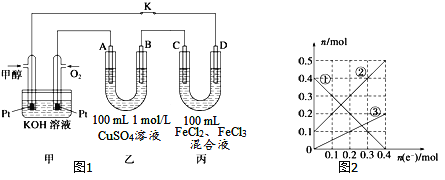
①乙中B极的电极反应式_______。
②乙中A极析出的气体在标况下的体积________。
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则②线表示的是____的变化,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要____mL 5mol/LNaOH溶液。
(4)蓄电池是一种反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应如下:NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
①此蓄电池在充电时,电池负极应与外加电源的________极连接。
②放电时正极的电极反应式为_____________________。
(5)按如图所示装置进行下列不同的操作

①将K1 、K2、 K3分别只关闭一个,则铁的腐蚀的速度最快的是只闭合_____(填“K1”或 “K2”或“K3”,下同),为减缓铁的腐蚀, 只闭合_____,该防护法称为______________。
②只闭合K3,当铁棒质量减少5.6g时,石墨电极消耗的气体体积为__________L(标准状况)。
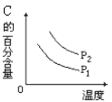
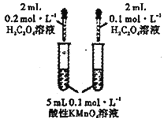
【题目】根据下列操作及现象,所得结论不正确的是![]()
![]()
序号 | 操作及现象 | 结论 |
A | 将 |
|
B | “ |
|
C | 向25mL冷水和沸水中分别滴入5滴 | 温度升高, |
D | 将固体 | 同温下溶解度:
|
A. A B. B C. C D. D