题目内容
【题目】下列说法正确的是( )
A.反应2Mg+CO2![]() 2MgO+C ΔH<0从熵变角度看,可自发进行
2MgO+C ΔH<0从熵变角度看,可自发进行
B.在密闭容器发生可逆反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
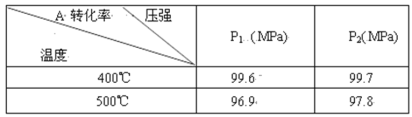
C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生
D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7, Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者
【答案】D
【解析】
A.反应2Mg+CO2![]() 2MgO+C ΔH<0,从熵变角度看,该反应的混乱程度减小,因此不可自发进行,错误;
2MgO+C ΔH<0,从熵变角度看,该反应的混乱程度减小,因此不可自发进行,错误;
B.2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,即增大压强,化学平衡向正反应方向移动,重新达到平衡后,由于温度不变,所以ΔH不变,错误;
N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,即增大压强,化学平衡向正反应方向移动,重新达到平衡后,由于温度不变,所以ΔH不变,错误;
C.将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,反应产生AgCl沉淀需要的Ag+的浓度是c(Ag+)= 1.8×10-10÷1.0×10-4=1.8×10-6mol/L;反应产生Ag2CrO4沉淀需要的c(Ag+)=![]() ,可见先产生AgCl沉淀,错误;
,可见先产生AgCl沉淀,错误;
D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,CO32-水解程度大于ClO-,所以pH前者小于后者,正确。

【题目】在100℃时,将0.1mol的四氧化二氮气体充入1 L抽空的密闭容器中,发生反应,隔一定时间对该容器内的物质进行分析,得到如下数据:
浓度 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L—1 | 0.1 | c1 | 0.05 | c3 | a | b |
c(NO2)/mol·L—1 | 0 | 0.06 | c2 | 0.12 | 0.12 | 0.12 |
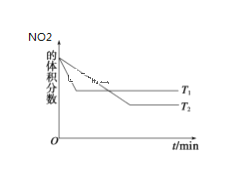
(1)该反应的化学方程式为______________________,表中c2_____c3_____a______b(选填“>”、“<”、“==”)。
(2)20 s时四氧化二氮的浓度c1=____________mol·l—1依据图象可以判断该反应的 ΔH___0(填“>”或“<”)