题目内容
【题目】利用下列装置分别完成相关实验,能达到实验目的是![]()
A | B | C | D |
制备并收集氨气 | 比较 | 用NaOH溶液滴定锥形瓶中的盐酸溶液 | 制备乙酸乙酯 |
|
|
|
|
A.AB.BC.CD.D
【答案】D
【解析】
A.固体反应有水生成;
B.碳酸钠稳定,碳酸氢钠加热分解;
C.NaOH溶液与二氧化硅反应生成具有粘合性的硅酸钠,应选碱式滴定管;
D.乙酸与乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯,饱和碳酸钠除去乙酸、乙醇,与乙酸乙酯分层。
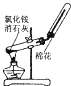
![]() 固体反应有水生成,试管口应向下倾斜,故A错误;
固体反应有水生成,试管口应向下倾斜,故A错误;
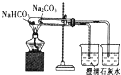
B.碳酸钠稳定,碳酸氢钠加热分解,小试管中应为碳酸氢钠,能起对比作用,故B错误;
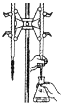
C.NaOH溶液与二氧化硅反应生成具有粘合性的硅酸钠,应选碱式滴定管,图中滴定管选取不合理,故C错误;
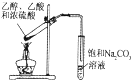
D.乙酸与乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯,饱和碳酸钠除去乙酸、乙醇,与乙酸乙酯分层,图中制备实验合理,故D正确;
故选:D。

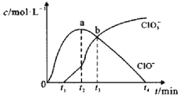
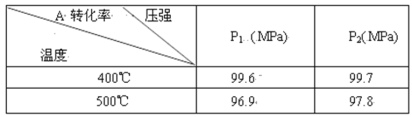
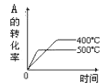
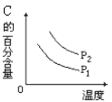
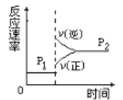
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.40 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是( )
A.根据实验①、②可以推测该反应正反应△H>0
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
【题目】甲醇是重要的化工原料。在催化剂的作用下,利用合成气(主要成分为CO、CO2和H2)合成甲醇的主要化学反应如下:
Ⅰ.CO+2H2![]() CH3OH
CH3OH
Ⅱ.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
Ⅲ.CO2+H2![]() CO+H2O
CO+H2O
请回答下列问题:
(1)已知三种物质的标准燃烧热如下表:
物质 | CO(g) | H2(g) | CH3OH(l) |
燃烧热(kJ·mol1) | 283.0 | 285.8 | 726.5 |
①书写25℃、101kPa条件时CO燃烧热的热化学方程式____________。
②计算25℃、101kPa条件时反应Ⅰ的ΔH=_____kJ·mol1 。
(2)甲醇燃料电池(Direct Methanol Fuel Cell)属于质子交换膜燃料电池,其工作原理如图所示:
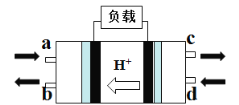
①c处产生的气体是_______________;
②负极的电极反应式是_______________。
(3)下图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A,B两极上产生的气体体积相同。
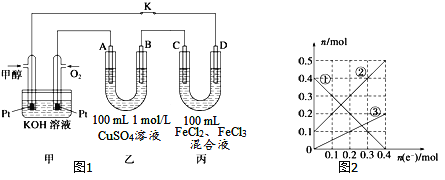
①乙中B极的电极反应式_______。
②乙中A极析出的气体在标况下的体积________。
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则②线表示的是____的变化,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要____mL 5mol/LNaOH溶液。
(4)蓄电池是一种反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应如下:NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
①此蓄电池在充电时,电池负极应与外加电源的________极连接。
②放电时正极的电极反应式为_____________________。
(5)按如图所示装置进行下列不同的操作

①将K1 、K2、 K3分别只关闭一个,则铁的腐蚀的速度最快的是只闭合_____(填“K1”或 “K2”或“K3”,下同),为减缓铁的腐蚀, 只闭合_____,该防护法称为______________。
②只闭合K3,当铁棒质量减少5.6g时,石墨电极消耗的气体体积为__________L(标准状况)。