题目内容
【题目】水是生命的源泉、工业的血液、城市的血脉。要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)纯水在T ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液中,由水电离出的c(OH-)=________ mol·L-1。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其主要水解反应的离子方程式为____________________,由水电离出的c(OH-)=________mol·L-1。
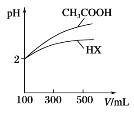
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”“小于”或“等于”)CH3COOH的电离平衡常数。
(4)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
在25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。
【答案】10-11 CO32-+H2O![]() HCO3-+OH- 10-3 小于 Na2CO3 > NaCN > CH3COONa
HCO3-+OH- 10-3 小于 Na2CO3 > NaCN > CH3COONa
【解析】
(1)根据水的离子积常数表达式,计算水电离出的氢氧根离子浓度;
(2)碳酸钠溶液中因碳酸根离子水解导致溶液显碱性,盐溶液中盐的水解促进水的电离;
(3)据图分析,加水稀释的过程中,HX的pH变化比较慢,说明HX的酸性比醋酸弱;
(4)根据酸的电离常数进行分析判断,电离常数越大,对应盐的水解程度越小,溶液的pH越小。
(1)纯水在T ℃时,pH=6,Kw=1012,该温度下0.1molL1的NaOH溶液中,c(OH)=1molL1,则由水电离出的c(OH)=c(H+)=![]() =1011mol/L,故答案为:1011;
=1011mol/L,故答案为:1011;
(2)碳酸钠溶液中因碳酸根离子水解导致溶液显碱性,碳酸根水解的离子方程式为CO32-+H2O![]() HCO3-+OH-、HCO3+H2OH2CO3+OH,第一步水解为主要过程;其pH=11,则c(H+)=10-11,则c(OH)=
HCO3-+OH-、HCO3+H2OH2CO3+OH,第一步水解为主要过程;其pH=11,则c(H+)=10-11,则c(OH)=![]() =10-3,全部由水电离产生,故答案为:CO32-+H2O
=10-3,全部由水电离产生,故答案为:CO32-+H2O![]() HCO3-+OH- ;10-3;
HCO3-+OH- ;10-3;
(3)据图分析,加水稀释的过程中,HX的pH变化比较小,说明HX的酸性比醋酸弱,HX的电离平衡常数比醋酸小,故答案为:小于;
(4)根据图表数据分析,电离常数:CH3COOH>HCN>HCO3-,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,水解程度越大,c(OH-)越大,pH越大,故溶液的pH为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故答案为:Na2CO3 > NaCN > CH3COONa。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】氨可用于制取氨水、氮肥、硝酸、铵盐、纯碱等,因此被广泛应用于化工、轻工、化肥、制药、合成纤维、塑料等行业.
(1)以甲烷为原料可制得合成氨用的氢气,有关反应的能量变化如下图所示:



写出CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式:_______________。
(2)已知N2(g)+3H2(g)![]() 2NH3(g);△H= -94.4kJ·mol-1,在某容积为2L的恒容容器中发生合成氨反应,体系中各物质浓度随时间变化的曲线如图所示:
2NH3(g);△H= -94.4kJ·mol-1,在某容积为2L的恒容容器中发生合成氨反应,体系中各物质浓度随时间变化的曲线如图所示:

①前20min内v(NH3)=________mol/(L·min),放出的热量为________。
②45min时采取的措施是________;时段III条件下反应的平衡常数为________(保留3位有效数字)。
(3)一定温度下,将不同量的CO2、NH3分别通入某恒容密闭容器中进行下列反应:2NH3(g)+CO2(g)=CO(NH2)2(l)+H2O(g);△H<0,得到如下数据:
实验组 | 起始量/mol | 平衡时的转化率 | 平衡时气体平均相对分子质量 | ||
NH3(g) | CO2(g) | NH3(g) | CO2(g) | ||
1 | 2 | 1 | a1 | a2 | M1 |
2 | 4 | 2 | a3 | a4 | M2 |
3 | n1 | n2 | a5 | a6 | M3 |
①a1________a4(填“<”、“=”或“>”);M1________ M2(填“<”、“=”或“>”)。
②若a5>a6,则n1,n2必须满足的关系是________。
(4)室温时将氨通入500mL 0.1mol·L-1盐酸中至pH=6,所得溶液中离子浓度由大到小的顺序是____________________________________________。
(5)氨、空气、KOH溶液可构成燃料电池,反应原理为4NH3+3O2=2N2+6H2O,反应一段时间后,电解质溶液的pH将________(填“增大”“减小”或“不变”)。
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
请回答下列问题:
(1)反应②是________(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示);根据反应③判断ΔS___0(填“>”、“=”或“<”),在______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mo/L、0.15mol/L,则此时v正________v逆(填“>”、“=”或“<”)。