��Ŀ����
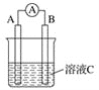
����Ŀ����1����ͼ��ʾ����CΪŨ���ᣬ������ָ�뷢��ƫת��B�缫����ΪFe ,A�缫����ΪCu����B�缫�ĵ缫��ӦʽΪ___________��A�缫�ĵ缫��ӦʽΪ_______����Ӧ����һ��ʱ�����ҺC��pH��___ (����ߡ������͡��������䡱)��
��2���ҹ��״�����������ˮ�����Ϊ��Դ�����͵ĺ�ˮ��־�ƣ��Ժ�ˮΪ�������Һ���������е�����ʹ����������������������ֻҪ�ѵƷ��뺣ˮ�����ӣ��ͻᷢ��ҫ�۵İ⡣���Դ�ĸ���������____��������ӦΪ___________��������ӦΪ_____________________________��
��3�����ε�ؾ��иߵķ���Ч�ʣ�����ܵ����ӣ�����Li2CO3��Na2CO3�������λ����������ʣ�COΪ����ȼ����������CO2�Ļ����Ϊ������ȼ�����Ƶ���650 ���¹�����ȼ�ϵ�أ�����йص�ط�Ӧʽ��������ӦʽΪ2CO��2CO32-��4e��=4CO2��������ӦʽΪ___________������ܷ�ӦʽΪ_______��
���𰸡�4H++ 2NO3��+2e-=2NO2��+2H2O Cu-2e-=Cu2+ ���� �� 4Al��12e��=4Al3�� 3O2��6H2O��12e��=12OH�� O2��2CO2��4e��=2CO 2CO��O2=2CO2
��������
��1������ͭ��������Ũ�������������Һ����������Ũ�����лᷢ���ۻ�������ͭ�Ǹ����������������ڸ�����ͭʧȥ���ӱ��ͭ���ӣ�����������Һ�е���������ӵõ������ɶ�������������������Ӧ���������ӣ�������Һ��pH���ߣ��ʴ�Ϊ��4H++2NO3��+2e-=2NO2��+2H2O�� Cu-2e-=Cu2+�����ߣ�
��2����-����-��ˮ����У����������е����������������������������������������ڸ�������ʧȥ���ӱ�������ӣ���������������õ��ӡ��ʴ�Ϊ������4Al��12e��=4Al3����3O2��6H2O��12e��=12OH����
��3��һ����̼�Ǹ���ȼ���������Ͷ�����̼�Ļ������������ȼ������ص��ܷ�Ӧ����һ����̼ȼ�յķ�Ӧ����2CO+O2=2CO2�����ܷ�Ӧʽ��ȥ������Ӧʽ�����ɵ�������Ӧʽ���ʴ�Ϊ��O2��2CO2��4e��=2CO�� 2CO��O2=2CO2��

 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�����Ŀ��2018�꣬�����˳��ˡ�����Э����ʵ���ٹ�ҵ��ս�ԣ����й�ȴ�Ӵ��˻������ȣ�����ڹ�����ҹ������εĴ���������ҹ�������ǿ��������CO2���⻯�ϳɼ״������Ĺ�ҵ�������о���ʵ�ֿɳ�����չ��
��1����֪��CO2(g)+H2(g)![]() H2O(g) +CO(g)����H1 = + 41.1 kJmol-1
H2O(g) +CO(g)����H1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g)����H2=��90.0 kJmol-1
CH3OH(g)����H2=��90.0 kJmol-1
д��CO2���⻯�ϳɼ״����Ȼ�ѧ����ʽ��_______��
��2��Ϊ���CH3OH���ʣ�������Ӧ���õ�������_______������ĸ����
a.���¸�ѹ b.���µ�ѹ c.���µ�ѹ d.���¸�ѹ
��3��250�桢�ں����ܱ���������CO2(g)���⻯�ϳ�CH3OH(g)����ͼΪ��ͬͶ�ϱ�[n(H2)/n(CO2)]ʱij��Ӧ��Xƽ��ת���ʱ仯���ߡ�
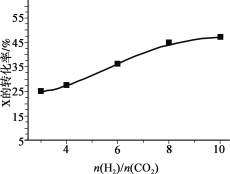
�� ��Ӧ��X��_______������CO2������H2������
�� �������_______��
��4��250�桢�����Ϊ2.0L�ĺ����ܱ������м���6mol H2��2mol CO2�ʹ�����10minʱ��Ӧ�ﵽƽ�⣬���c(CH3OH) = 0.75 mol�� L��1��
�� ǰ10min��ƽ����Ӧ����v(H2)��_______ mol��L��1��min ��1��
�� ��ѧƽ�ⳣ��K = _______��
�� �����ͷ�Ӧ�����뷴Ӧ��ת���ʺͲ����ѡ�����и߶���ء�������ͬͶ�ϱȺ���ͬ��Ӧʱ�䣬����ʵ���������£�
ʵ���� | �¶ȣ�K�� | ���� | CO2ת���ʣ�%�� | �״�ѡ���ԣ�%�� |
A | 543 | Cu/ZnO���װ� | 12.3 | 42.3 |
B | 543 | Cu/ZnO����Ƭ | 11.9 | 72.7 |
C | 553 | Cu/ZnO���װ� | 15.3 | 39.1 |
D | span>553 | Cu/ZnO����Ƭ | 12.0 | 70.6 |
�����ϱ��������ݣ���CO2�����״�������ѡ��Ϊ_______������ĸ����