题目内容
10.在下列事实中,什么因素影响了化学反应速率?(1)集气瓶中有H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸光;
(2)H2O2放出气泡很慢,撒入少量MnO2后很快产生气体催化剂;
(3)向同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体的速率有快有慢物质本身的性质;
(4)同样大小的石灰石分别与0.1mol•L-1的盐酸和1mol•L-1的盐酸反应,反应速率不同反应物浓度.
分析 影响化学反应速率的因素有浓度、温度、催化剂、压强、反应物接触面积等,据此分析解答.
解答 解:影响化学反应速率的因素有浓度、温度、催化剂、压强、反应物接触面积等,
(1)镁剧烈燃烧发出耀眼的强光,氯气和氢气在光照条件下发生反应生成HCl,所以影响其反应速率因素是光,故答案为:光;
(2)二氧化锰能加快双氧水的分解速率但本身性质不变,所以二氧化锰做催化剂,故答案为:催化剂;
(3)Mg、Zn与同浓度、同体积的盐酸反应,镁反应速率大于锌,说明物质本身的性质决定反应速率,故答案为:反应物本身的性质;
(4)反应物浓度越大,单位体积内活化分子越多,所以反应速率越快,故答案为:反应物的浓度.
点评 本题考查化学反应速率影响因素,外界因素只是影响因素,决定因素是物质本身的性质,题目难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
20.下列物质的沸点逐渐升高的是( )
| A. | NH3 PH3 AsH3 SbH3 | B. | Si SiC H2O CO2 | ||
| C. | NaI NaBr NaCl NaF | D. | Li Na K Rb |
1.下列关于甲烷的说法不正确的是( )
| A. | 甲烷的分子式是CH4,是H元素质量分数含量最高的烃 | |
| B. | 甲烷中最多三个原子共面 | |
| C. | CCl4可由CH4制得,CCl4可萃取碘水中的碘 | |
| D. | 1 mol甲烷和氯气光照充分反应,最多消耗2mol氯气 |
18.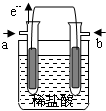 某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸.他们设计的原电池装置如下,其中两个电极均为多孔铂电极.下列有关叙述不正确的是( )
某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸.他们设计的原电池装置如下,其中两个电极均为多孔铂电极.下列有关叙述不正确的是( )
 某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸.他们设计的原电池装置如下,其中两个电极均为多孔铂电极.下列有关叙述不正确的是( )
某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸.他们设计的原电池装置如下,其中两个电极均为多孔铂电极.下列有关叙述不正确的是( )| A. | a为负极,通入的气体为氢气 | |
| B. | 正极的电极反应式为:Cl2+2e-=2Cl- | |
| C. | 电流由b极流出,经外电路到a极 | |
| D. | 原电池内部,H+移向负极,Cl-移向正极 |
5.从海水中提取的溴占世界溴年产量的$\frac{1}{3}$左右.已知溴水呈橙色,将SO2气体通入溴水可以使溴水褪色.下列有关叙述中正确的是( )
| A. | SO2使溴水褪色,显示了SO2的漂白性 | |
| B. | SO2使溴水褪色,显示了SO2的还原性 | |
| C. | 从溴水中提取单质溴,可以用乙醇进行萃取 | |
| D. | SO2是形成酸雨的唯一污染物 |
15.世界卫生组织(WHO)将二氧化氯ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用.下列说法正确的是( )
| A. | 二氧化氯是强氧化剂 | B. | 二氧化氯是强还原剂 | ||
| C. | 二氧化氯是离子化合物 | D. | 二氧化氯分子中氯为-1价 |
2.关于含正离子N5+的化合物N5ASF6,下列叙述中错误的是( )
| A. | N5+共有34个核外电子 | B. | N5+中氮原子间以共价键结合 | ||
| C. | 化合物N5ASF6中AS的化合价为+1价 | D. | 化合物N5ASF6中F的化合价为-1价 |
19.某有机物完全燃烧时只生成水和二氧化碳,且两者的物质的量之比为3:2,则( )
| A. | 该有机物含碳.氢.氧三种元素 | |
| B. | 该化合物是乙烷 | |
| C. | 该化合物分子中碳.氢原子个数之比是2:3 | |
| D. | 该有机物含2个碳原子,6个氢原子,但不能确定是否含氧原子 |
20.如图是氢氧燃料电池构造示意图.关于该电池说法正确的是( )
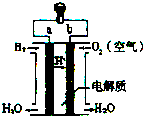

| A. | b是负极 | |
| B. | 需要点燃该电池才能开始工作 | |
| C. | 工作时能观察到淡蓝色火焰 | |
| D. | 氢氧燃料电池是一种高效环境友好的发电装置 |