题目内容
13.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )| A. | 在高温高压下,28 gN2和6g H2充分反应生成NH3的分子数为2NA | |
| B. | 1mol/LFeCl3 溶液中所含Fe3+的数目小于NA | |
| C. | 常温下,1L pH=12的Ba(OH)2 溶液中含OH-的数目为2NA | |
| D. | 23g NO2和N2O4的混合气体中含有氮原子数为0.5NA |
分析 A、合成氨的反应为可逆反应;
B、溶液的体积不明确;
C、求出OH-的浓度,然后根据n=CV来计算;
D、NO2和N2O4的最简式均为NO2;
解答 解:A、合成氨的反应为可逆反应,不能进行彻底,故得到的氨气分子的个数小于2NA个,故A错误;
B、溶液的体积不明确,Fe3+的个数无法计算,故B错误;
C、溶液中的OH-的浓度C=0.01mol/L,故氢氧根的物质的量n=CV=0.01mol/L×1L=0.01mol,个数为0.01NA个,故C错误;
D、NO2和N2O4的最简式均为NO2,故23g混合物中含有的NO2的物质的量n=$\frac{23g}{46g/mol}$=0.5mol,故含有0.5mol氮原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
4.下列有关说法不正确的是( )
| A. | 要清洗附着在试管壁上的硫,可用的试剂是CS2 | |
| B. | 硫化亚铁溶于稀硝酸中反应的化学方程式为:FeS+2HNO3→Fe(NO3)2+H2S↑ | |
| C. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 | |
| D. | 在Na2SO3和BaCO3混合物中加入过量的稀硫酸,能产生气泡并有沉淀生成 |
1.下列关于甲烷的说法不正确的是( )
| A. | 甲烷的分子式是CH4,是H元素质量分数含量最高的烃 | |
| B. | 甲烷中最多三个原子共面 | |
| C. | CCl4可由CH4制得,CCl4可萃取碘水中的碘 | |
| D. | 1 mol甲烷和氯气光照充分反应,最多消耗2mol氯气 |
18.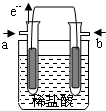 某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸.他们设计的原电池装置如下,其中两个电极均为多孔铂电极.下列有关叙述不正确的是( )
某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸.他们设计的原电池装置如下,其中两个电极均为多孔铂电极.下列有关叙述不正确的是( )
 某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸.他们设计的原电池装置如下,其中两个电极均为多孔铂电极.下列有关叙述不正确的是( )
某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸.他们设计的原电池装置如下,其中两个电极均为多孔铂电极.下列有关叙述不正确的是( )| A. | a为负极,通入的气体为氢气 | |
| B. | 正极的电极反应式为:Cl2+2e-=2Cl- | |
| C. | 电流由b极流出,经外电路到a极 | |
| D. | 原电池内部,H+移向负极,Cl-移向正极 |
5.从海水中提取的溴占世界溴年产量的$\frac{1}{3}$左右.已知溴水呈橙色,将SO2气体通入溴水可以使溴水褪色.下列有关叙述中正确的是( )
| A. | SO2使溴水褪色,显示了SO2的漂白性 | |
| B. | SO2使溴水褪色,显示了SO2的还原性 | |
| C. | 从溴水中提取单质溴,可以用乙醇进行萃取 | |
| D. | SO2是形成酸雨的唯一污染物 |
2.关于含正离子N5+的化合物N5ASF6,下列叙述中错误的是( )
| A. | N5+共有34个核外电子 | B. | N5+中氮原子间以共价键结合 | ||
| C. | 化合物N5ASF6中AS的化合价为+1价 | D. | 化合物N5ASF6中F的化合价为-1价 |
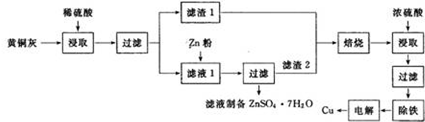 铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.
铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.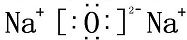 NaOH
NaOH Na2O2
Na2O2
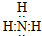 CO2
CO2 HClO
HClO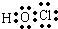 .
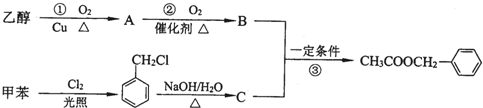
.
 .
.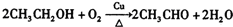 .
.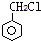 的属于芳香族化合物的同分异构体有3种.
的属于芳香族化合物的同分异构体有3种.