题目内容
14.有机化工原料1,4-二苯基-1,3-丁二烯及某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
已知:

(1)抗结肠炎药物有效成分分子中的含氧官能团名称是羧基、羟基.
(2)D的结构简式是

(3)写出F与NaOH反应的化学方程式
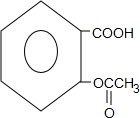 +3NaOH→
+3NaOH→ +CH3COONa+2H2O.
+CH3COONa+2H2O.(4)下列说法正确的是BD(填选项字母).
A.④的反应条件X和⑤的反应条件Y完全相同
B.①②④⑤反应类型相同
C.G不可以发生缩聚反应
D.设计D→E和F→G两步反应的目的是防止酚羟基被氧化
(5)检验
 有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色白色沉淀,则证明有氯元素.
有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色白色沉淀,则证明有氯元素.(6)③的化学方程式是
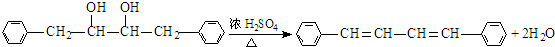 .
.(7)E有多种同分异构体,符合下列条件的同分异构体有23种
①结构中有苯环 ②与E有相同的官能团
(8)1,4-二苯基-1,3-丁二烯有多种同分异构体,写出符合下列条件的同分异构体的结构简式:
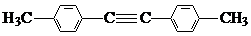
a.结构中有两个苯环,无其它环状结构
b.苯环上的一硝基取代产物有两种
c.其核磁共振氢谱有3种峰,峰面积之比为3:2:2.
分析 芳香烃A(C7H8)为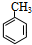 ,与氯气在光照条件下发生取代反应生成
,与氯气在光照条件下发生取代反应生成 ,
, 发生信息Ⅰ中反应生成K为
发生信息Ⅰ中反应生成K为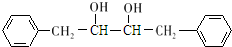 ;由
;由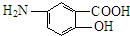 逆推可知J为
逆推可知J为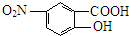 ,G为
,G为 ,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为
,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为 ,F为
,F为 ,则D为
,则D为 ,B为
,B为 ,据此解答.
,据此解答.
解答 解:芳香烃A(C7H8)为 ,与氯气在光照条件下发生取代反应生成
,与氯气在光照条件下发生取代反应生成 ,
, 发生信息Ⅰ中反应生成K为
发生信息Ⅰ中反应生成K为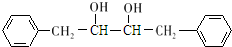 ;由
;由 逆推可知I为
逆推可知I为 ,G为
,G为 ,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为
,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为 ,F为
,F为 ,则D为
,则D为 ,B为
,B为 ,
,
(1)抗结肠炎药物有效成分分子中的含氧官能团名称是:羧基、羟基,故答案为:羧基、羟基;
(2)D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为 ,F为
,F为 ,则D为
,则D为 ,故答案为:
,故答案为: ;
;
(3)F为 ,其与NaOH溶液反应时,除发生酯的水解还有NaOH与酚羟基和羧基的中和,1molF能够消耗3molNaOH,反应方程式为:
,其与NaOH溶液反应时,除发生酯的水解还有NaOH与酚羟基和羧基的中和,1molF能够消耗3molNaOH,反应方程式为: +3NaOH→
+3NaOH→ +CH3COONa+2H2O,
+CH3COONa+2H2O,
故答案为: +3NaOH→
+3NaOH→ +CH3COONa+2H2O;
+CH3COONa+2H2O;
(4)A、B为 ,④是在苯环上的卤代反应,反应条件为铁作催化剂,⑤为甲基上的卤代,光照条件下反应,故A错误;
,④是在苯环上的卤代反应,反应条件为铁作催化剂,⑤为甲基上的卤代,光照条件下反应,故A错误;
B、据上述分析,①②④⑤都是取代反应,故B正确;
C、G为 ,可以通过酯化反应发生缩聚反应,故C错误;
,可以通过酯化反应发生缩聚反应,故C错误;
D、E发生氧化发生成F,会氧化D中的酚羟基,设计D→E和F→G两步反应的目的是:防止酚羟基被氧化,故D正确;
故答案为:BD;
(5) 是非电解质,不能发生电离,将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色白色沉淀,则证明有氯元素,
是非电解质,不能发生电离,将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色白色沉淀,则证明有氯元素,
故答案为:将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色白色沉淀,则证明有氯元素;
(6)反应③的化学方程式是: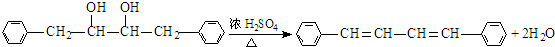 ,
,
故答案为: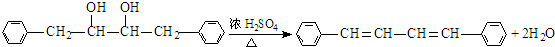 ;
;
(7)E为 ,其同分异构体①结构中有苯环,②与E有相同的官能团,含有酯基;若只有1个取代基,可以是丙酸酚酯基,有1种,苯甲醇乙酸酯1种;苯乙醇甲酸酯2种;苯甲酸乙酯1种;苯乙酸甲酯1种;若有两个取代基,甲基和乙酸酚酯基,邻间对三种;甲基与苯甲酸甲酯,邻间对3种;甲基与苯甲醇甲酸酯,临间对3种;乙基与甲酸酚酯基,邻间对三种;有三个取代基,两个甲基和一个甲酸酚酯基,按定一移二的原则,有6种,共有24种,不含E本身,还有23种,
,其同分异构体①结构中有苯环,②与E有相同的官能团,含有酯基;若只有1个取代基,可以是丙酸酚酯基,有1种,苯甲醇乙酸酯1种;苯乙醇甲酸酯2种;苯甲酸乙酯1种;苯乙酸甲酯1种;若有两个取代基,甲基和乙酸酚酯基,邻间对三种;甲基与苯甲酸甲酯,邻间对3种;甲基与苯甲醇甲酸酯,临间对3种;乙基与甲酸酚酯基,邻间对三种;有三个取代基,两个甲基和一个甲酸酚酯基,按定一移二的原则,有6种,共有24种,不含E本身,还有23种,
故答案为:23;
(8)1,4-二苯基-1,3-丁二烯有多种同分异构体中,符合下列条件:a.结构中有两个苯环,无其它环状结构,b.苯环上的一硝基取代产物有两种,c.其核磁共振氢谱有3种峰,峰面积之比为3:2:2,符合条件的同分异构体为: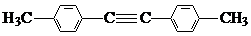
故答案为: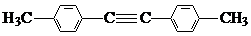
点评 本题考查有机物推断,需要学生对给予的信息进行利用,能较好的考查学生自学能力,需要学生熟练掌握官能团性质与转化,结合转化关系中有机物的结构利用逆推法进行推断,对学生的推理有一定的要求,难度中等.

| A. | 分子中含有碳碳双键 | B. | 可作水果催熟剂 | ||
| C. | 分子式为C2H6 | D. | 能使溴水褪色 |
| A. | NH4HCO3与盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能 | |
| D. | 该反应的反应物和生成物的能量高低与醋酸的凝固无关 |
2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1
H-H、O-H和O=O键的键能分别为436、462和akJ•mol-1,则a为( )
| A. | 1352 | B. | 1456 | C. | 496 | D. | 360 |
| A. | 该图表示的是“节能减排”中的节能标志 | |
| B. | 加快化石燃料的开采与使用,停止使用核能 | |
| C. | 安装煤炭“固硫”、“脱硝”装置,降低酸雨发生率 | |
| D. | 推广农作物的生物防治技术,减少农药的使用 |
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.(1)滴定:①用酸式滴定管盛装1.00mol/L盐酸标准液.如图表示某次滴定时50mL滴定管中前后液面的位置.请将用去的标准盐酸的体积填入③表空格中.滴定管中剩余液体的体积大于.0.10mL(填大于、小于或者等于).
②下表是3种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 酚酞 |
| 变色范围(pH) | 5.0-8.0 | 3.1-4.4 | 8.2-10.0 |
③有关数据记录如下:
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 20 | 0.50 | 25.12 | 24.62 |
| 2 | 20 | 如图 | 如图 | 填写24.60 |
| 3 | 20 | 6.00 | 30.58 | 24.58 |
(3)下列几种情况会使测定结果偏高的是ce
a.若滴定前用蒸馏水冲洗锥形瓶;
b.滴定后俯视读数;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外;
d.若未充分振荡,刚看到溶液变色,立刻停止滴定.
e.未用标准液润洗酸式滴定管.


 .
.