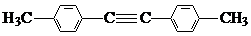题目内容
5.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈醋酸逐渐凝固.下列说法正确的是( )| A. | NH4HCO3与盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能 | |
| D. | 该反应的反应物和生成物的能量高低与醋酸的凝固无关 |
分析 A.依据反应后醋酸凝固,说明反应是吸热反应;
B.吸热反应把能量转化为产物内部能量;
C.依据反应前后能量守恒分析判断;
D.因为反应吸热,温度降低才导致醋酸凝固.
解答 解:A.醋酸逐渐凝固说明反应吸收热量导致醋酸溶液温度降低,即NH4HCO3与HCl的反应为吸热反应,故A错误;
B.因反应为吸热反应,即吸热的热量转化为产物内部的能量,故B正确;
C.因反应为吸热反应,则反应后生成物的总能量高于反应物的总能量,故C错误;
D.溶液温度降低,导致醋酸凝固,故D错误;
故选B.
点评 本题考查化学反应能量变化判断,热化学方程式书写方法,能量守恒的应用分析是解题关键,题目难度中等.

练习册系列答案
相关题目
15.下列排列顺序正确的是( )
| A. | 半径:Al3+>Mg2+>Na+>F- | B. | 稳定性:HI<HBr<HCl<HF | ||
| C. | 酸性:HClO4<H2SO4<H3PO4 | D. | 碱性:Al(OH)3>Mg(OH)2>Ca(OH)2 |
16.已知Na2S2O3溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,某小组为了探究温度与反应物浓度对化学反应速率的影响,做了A、B、C、D四组实验:
(1)以上各组实验中最先出现浑浊的是C,D组实验中V=10 mL
(2)能证明稀H2SO4[的浓度对反应速率的影响的两组实验为CD,能证明温度对反应速率的影响的两组实验为AC.
| 实验 | 反应温度/℃ | Na2S2O3溶液[] | 稀H2SO4[.Com][.Com] | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| A | 25 | 5 | 0.2 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
| D | 35 | 10 | 0.1 | 5 | 0.1 | V |
(2)能证明稀H2SO4[的浓度对反应速率的影响的两组实验为CD,能证明温度对反应速率的影响的两组实验为AC.
13.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 乙烷不能发生加成反应,而乙烯能发生加成反应 | |
| B. | 苯在50℃~60℃时发生硝化反应,而甲苯在30℃时即可 | |
| C. | 乙烷不能使酸性高锰酸钾溶液褪色,而甲苯能使酸性高锰酸钾溶液褪色 | |
| D. | 乙醇不能与NaHCO3溶液反应,而乙酸能与NaHCO3溶液反应 |
20.从溴乙烷制取1,2-二溴乙烷,下列转化方案中最好的是( )
| A. | CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CHOH$→_{170℃}^{浓H_{2}SO_{4}}$CH2═CH2$\stackrel{Br}{→}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$→_{醇溶液}^{NaOH}$CH2═CH2$\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br}{→}$CH2BrCH2Br | |
| D. | CH2BrCH2Br$\stackrel{NaOH醇溶液}{→}$CH2═CH2$\stackrel{Br}{→}$CH2BrCH2Br |
10.下列物质的熔、沸点高低顺序正确的是( )
| A. | 金刚石,晶体硅,碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>CsCl>NaCl | D. | Na>Mg>Al |
17.用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会( )
| A. | 偏大 | B. | 偏小 | C. | 无影响 |
15.工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如图:
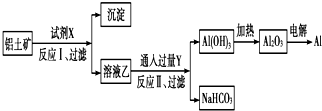
对上述流程中的判断不正确的是( )

对上述流程中的判断不正确的是( )
| A. | 试剂X为NaOH溶液 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为:CO2+[Al(OH)4]-═Al(OH)3↓+HCO3- | |
| C. | 结合质子(H+)的能力由强到弱的顺序是OH->[Al(OH)4]->CO32- | |
| D. | 工业上还可采用热还原法冶炼Al |


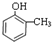
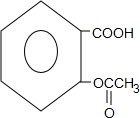 +3NaOH→
+3NaOH→ +CH3COONa+2H2O.
+CH3COONa+2H2O. 有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色白色沉淀,则证明有氯元素.
有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色白色沉淀,则证明有氯元素.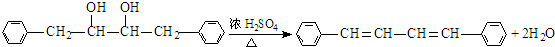 .
.