题目内容
2.资源的开发利用和保护环境关系到人类可持续发展,需要全社会的共同努力.信息时代产生的大量电子垃圾对环境构成了极大的威胁.某课题小组根据废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质,他们设计如下流程,以此玻璃粉末为原料,制得
Ce(OH)4和硫酸铁铵矾[Fe2(SO4)3•(NH4)2SO4•24H2O].

已知:
Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸,也不溶于NaOH溶液.
回答以下问题:
(1)反应①加NaOH溶液,玻璃粉末中的SiO2(写化学式)转化为可溶性物质.
(2)反应②中H2O2的作用是氧化Fe2+使之转化为Fe3+.
(3)反应③的离子方程式是2CeO2+6H++H2O2=2 Ce3++4H2O+O2↑.
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+ (水层)+6HT(有机层)?2CeT3(有机层)+6H+(水层)
从平衡角度解释:向CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是混合液中加入H2SO4使c(H+)增大,平衡向形成Ce3+水溶液方向移动.在实验室中进行萃取分液操作必需的仪器有铁架台(含铁圈)、分液漏斗和烧杯,振荡,静置,当液体分层后,接下来的操作是打开分液漏斗上口塞子(或将分液漏斗上口塞子凹槽对准漏斗口颈上小孔);先打开活塞放出下层液体,后将上层液体从分液漏斗上口倒入另一烧杯中.
(5)相同物质的量浓度的以下四种溶液中,NH4+的浓度由大到小的顺序是A>C>B>D(填字母).
A.Fe2(SO4)3•(NH4)2SO4•24H2O B.(NH4)2CO3 C.(NH4)2SO4 D.NH4HSO4.
分析 将玻璃粉末溶于NaOH溶液,SiO2和NaOH反应生成可溶性的Na2SiO3,Fe2O3、CeO2、FeO和NaOH不反应,然后采用过滤方法分离,则滤液A中含有NaOH、Na2SiO3,滤渣A中含有Fe2O3、CeO2、FeO;
向滤渣中加入稀硫酸,CeO2不溶于稀硫酸,也不溶于NaOH溶液,所以Fe2O3、FeO溶于稀硫酸,采用过滤方法得到滤渣B为CeO2,滤液B中含有Fe2(SO4)3、FeSO4,向滤液中加入双氧水,双氧水将亚铁离子氧化为铁离子,得到溶液C为Fe2(SO4)3,向溶液C中加入硫酸铵并加热得到Fe2(SO4)3•(NH4)2SO4,然后采用蒸发浓缩、冷却结晶、过滤方法得到硫酸铁铵钒;
向滤渣CeO2中加入稀硫酸、双氧水,Ce4+有较强氧化性,发生反2CeO2+6H++H2O2=2 Ce3++4H2O+O2↑,得到Ce3+溶液,然后采用萃取方法将Fe3+从水溶液中萃取出来,再利用反萃取法得到Ce3+浓溶液,然后加入碱并通入氧气得到Ce(OH)4;
(1)二氧化硅属于酸性氧化物,能溶于强碱溶液;
(2)反应②中H2O2具有强氧化性,能氧化还原性离子;
(3)反应③的离子方程式是2CeO2+6H++H2O2=2 Ce3++4H2O+O2↑;
(4)增大硫酸浓度,平衡逆向移动;根据分液操作方法解答;
(5)相同物质的量浓度的以下四种溶液中,铵根离子水解程度越大,则NH4+的浓度越小.
解答 解:将玻璃粉末溶于NaOH溶液,SiO2和NaOH反应生成可溶性的Na2SiO3,Fe2O3、CeO2、FeO和NaOH不反应,然后采用过滤方法分离,则滤液A中含有NaOH、Na2SiO3,滤渣A中含有Fe2O3、CeO2、FeO;
向滤渣中加入稀硫酸,CeO2不溶于稀硫酸,也不溶于NaOH溶液,所以Fe2O3、FeO溶于稀硫酸,采用过滤方法得到滤渣B为CeO2,滤液B中含有Fe2(SO4)3、FeSO4,向滤液中加入双氧水,双氧水将亚铁离子氧化为铁离子,得到溶液C为Fe2(SO4)3,向溶液C中加入硫酸铵并加热得到Fe2(SO4)3•(NH4)2SO4,然后采用蒸发浓缩、冷却结晶、过滤方法得到硫酸铁铵钒;
向滤渣CeO2中加入稀硫酸、双氧水,Ce4+有较强氧化性,发生反2CeO2+6H++H2O2=2 Ce3++4H2O+O2↑,得到Ce3+溶液,然后采用萃取方法将Fe3+从水溶液中萃取出来,再利用反萃取法得到Ce3+浓溶液,然后加入碱并通入氧气得到Ce(OH)4;
(1)SiO2属于酸性氧化物,能溶于强碱溶液,所以反应①加NaOH溶液,玻璃粉末中的SiO2 转化为可溶性物质,故答案为:SiO2;
(2)反应②中H2O2具有强氧化性,二价铁离子具有还原性,所以双氧水能氧化还原性Fe2+使之转化为Fe3+,
故答案为:氧化Fe2+使之转化为Fe3+;
(3)Ce4+有较强氧化性,酸性条件下,CeO2能被双氧水还原生成Ce3+,反应③的离子方程式是2CeO2+6H++H2O2=2 Ce3++4H2O+O2↑,
故答案为:2CeO2+6H++H2O2=2 Ce3++4H2O+O2↑;
(4)混合液中加入H2SO4使c(H+)增大,平衡向形成Ce3+水溶液方向移动;分液还需要的仪器是分液漏斗和烧杯,其操作方法是打开分液漏斗上口塞子(或将分液漏斗上口塞子凹槽对准漏斗口颈上小孔),先打开活塞放出下层液体,后将上层液体从分液漏斗上口倒入另一烧杯中,
故答案为:混合液中加入H2SO4使c(H+)增大,平衡向形成Ce3+水溶液方向移动;分液漏斗和烧杯;打开分液漏斗上口塞子(或将分液漏斗上口塞子凹槽对准漏斗口颈上小孔),先打开活塞放出下层液体,后将上层液体从分液漏斗上口倒入另一烧杯中;
(5)相同物质的量浓度的以下四种溶液中,铵根离子水解程度越大,则NH4+的浓度越小.
Fe2(SO4)3•(NH4)2SO4•24H2O中亚铁离子抑制铵根离子水解;
(NH4)2CO3 中碳酸根离子促进铵根离子水解;
(NH4)2SO4中铵根离子水解但程度大于A;
NH4HSO4中氢离子抑制铵根离子水解且程度大于A;
铵根离子能水解但程度较小,所以铵根离子浓度大小顺序是A>C>B>D,
故答案为:A>C>B>D.
点评 本题考查物质分离和提纯,为高频考查,涉及基本实验操作、盐类水解、氧化还原反应等知识点,明确流程图中物质的性质、基本操作方法是解本题关键,注意结合题给信息解答问题,题目难度中等,难点是(5)题铵根离子浓度大小比较.

| A. | 钾与钠同一主族,钠比钾更容易从水中置换出氢 | |
| B. | 溴化钾与碘化钾溶液置于空气中,溴化钾更容易被氧化 | |
| C. | 过渡元素都是副族元素 | |
| D. | 同周期元素的原子,半径越大,越容易失去电子 |
| A. | 乙烷不能发生加成反应,而乙烯能发生加成反应 | |
| B. | 苯在50℃~60℃时发生硝化反应,而甲苯在30℃时即可 | |
| C. | 乙烷不能使酸性高锰酸钾溶液褪色,而甲苯能使酸性高锰酸钾溶液褪色 | |
| D. | 乙醇不能与NaHCO3溶液反应,而乙酸能与NaHCO3溶液反应 |
| A. | 金刚石,晶体硅,碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>CsCl>NaCl | D. | Na>Mg>Al |
| A. | 偏大 | B. | 偏小 | C. | 无影响 |
| A. | Ba(OH)2•8H2O+2NH4Cl=BaCl2•6H2O+2NH3•2H2O+2H2O | |
| B. | Ba(OH)2+H2SO4=BaSO4↓+2H2O | |
| C. | 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ | |
| D. | 8Al+3Fe3O4=4Al2O3+9Fe |
| A. | 标准状况下,2.24 L CHCl3的碳原子总数为0.1 NA | |
| B. | 1 mol甲醇中含有C-H键的数目为4NA | |
| C. | 1 mol-OH中电子数为10 NA | |
| D. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA |
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)①,若测定结果偏高,其原因可能是ABCD.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红,且半分钟内不变色.
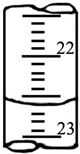
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60 mLmL.
(4)根据下列数据:请计算待测盐酸溶液的浓度:0.2000mol/L.
| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
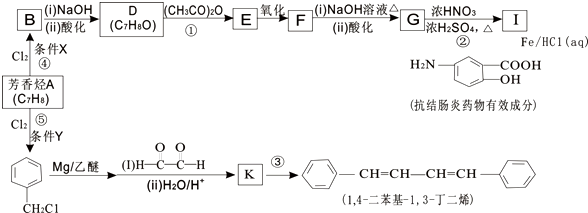
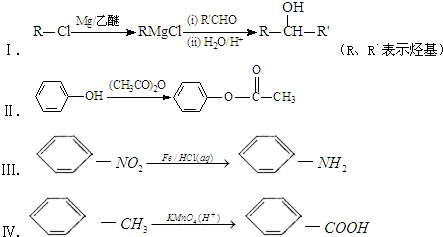
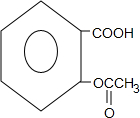 +3NaOH→
+3NaOH→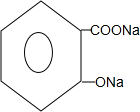 +CH3COONa+2H2O.
+CH3COONa+2H2O. 有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色白色沉淀,则证明有氯元素.
有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色白色沉淀,则证明有氯元素. .
.