题目内容
11.在一定条件下,当生成8g SO3气体时,并放出热量9.83kJ.已知SO2在此条件边转化率为80%,据此,下列热化学方程式正确的是( )| A. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98.3KJ•mol-1 | |
| B. | 2SO2(g)+O2(g)?2SO3(l);△H=-196.6KJ•mol-1 | |
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-78.64KJ•mol-1 | |
| D. | 2SO2(g)+O2(g)?2SO3(g);△H=+196.6KJ•mol-1 |
分析 8gSO3气体的物质的量为$\frac{8g}{80g/mol}$=0.1mol,侧转化的SO2的二氧化硫为0.1mol,故1molSO2反应放出
的热量为9.83kJ×$\frac{1mol}{0.1mol}$=98.3kJ,注明物质的聚集状态与反应热,书写热化学方程式,反应热与化学计量数成正比.
解答 解:A.8gSO3气体的物质的量为$\frac{8g}{80g/mol}$=0.1mol,侧转化的SO2的二氧化硫为0.1mol,故1molSO2反应放出的热量为9.83kJ×$\frac{1mol}{0.1mol}$=98.3kJ,反应热化学方程式为:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.3KJ•mol-1,故A正确;
B.2mol二氧化硫反应生成液体三氧化硫,放出的热量大于196.6kJ,故B错误;
C.1mol二氧化硫反应生成SO3(g),△H=-98.3KJ•mol-1,故C错误;
D.2mol二氧化硫反应生成SO3(g),△H=-196.6KJ•mol-1,故D错误,
故选A.
点评 本题考查热化学方程式书写,比较基础,注意掌握热化学方程式书写规则.

练习册系列答案
相关题目
2.下列离子方程式书写正确的是( )
| A. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | ||||||||
| B. | AlCl3溶液与烧碱溶液反应,当 n(OH-):n(Al3+ )=7:2时:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | ||||||||
| C. | 钠与CuSO4溶液反应,2Na+Cu2+═Cu↓+2Na+ | ||||||||
| D. | 已知碳酸和次氯酸的电离平衡常数如下:
|
19.硫酸铵[(NH4)2SO4]在分类上不应属于( )
| A. | 硫酸盐 | B. | 铵盐 | C. | 正盐 | D. | 酸式盐 |
16.已知A、B是元素周期表中第ⅦA族相邻元素,A、B所在周期分别有m、n种元素.若A的原子序数为x,则B的原子序数可能为( )
①x+m;②x-m;③x+n;④x-n.
①x+m;②x-m;③x+n;④x-n.
| A. | ②③ | B. | ①④ | C. | ①③ | D. | 全部 |
4. MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )| A. | ROH是一种强碱 | B. | 在x点,MOH并没有完全电离 | ||
| C. | 在x点,c(M+)=c(R+) | D. | 稀释前,c(ROH)=10c(MOH) |
1.已知N2(g)+3H2(g)?2NH3(g)(正反应放热).若在高温、高压和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是( )
| A. | 若降低温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 在上述条件下,N2的转化率能达到100% | |
| D. | 达到平衡时,N2、H2和NH3的浓度一定相等 |
2.下列有关叙述不正确的是( )
| A. | 油脂水解可得到丙三醇 | B. | 可用碘检验淀粉是否完全水解 | ||
| C. | 蛋白质水解的最终产物为氨基酸 | D. | 纤维素与淀粉互为同分异构体 |
 ,B
,B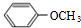 ,C
,C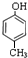 .
. ,②
,②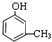 .
.