题目内容
1.已知N2(g)+3H2(g)?2NH3(g)(正反应放热).若在高温、高压和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是( )| A. | 若降低温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 在上述条件下,N2的转化率能达到100% | |
| D. | 达到平衡时,N2、H2和NH3的浓度一定相等 |
分析 A、根据降低温度,反应速率减慢;
B、根据催化剂可以加快反应速率;
C、根据可逆反应不可能完全进行到底;
D、根据平衡状态时的标志来判断;
解答 解:A、因降低温度,反应速率减慢,故A错误;
B、因催化剂可以加快反应速率,故B正确;
C、因可逆反应不可能完全进行到底,所以N2的转化率不能达到100%,故C错误;
D、因平衡状态时N2、H2和NH3的浓度不变,而不是相等,故D错误;
故选B.
点评 本题主要考查了影响化学反应速率的因素以及化学平衡的判断,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.在一定条件下,当生成8g SO3气体时,并放出热量9.83kJ.已知SO2在此条件边转化率为80%,据此,下列热化学方程式正确的是( )
| A. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98.3KJ•mol-1 | |
| B. | 2SO2(g)+O2(g)?2SO3(l);△H=-196.6KJ•mol-1 | |
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-78.64KJ•mol-1 | |
| D. | 2SO2(g)+O2(g)?2SO3(g);△H=+196.6KJ•mol-1 |
9.区别植物油和裂化汽油的正确方法是( )
| A. | 加酸性高锰酸溶液,振荡 | B. | 加NaOH溶液,煮沸 | ||
| C. | 加新制Cu(OH)2悬浊液,煮沸 | D. | 加溴水,振荡 |
6.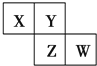 X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )
X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )
 X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )
X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )| A. | X、Y、Z的原子半径大小:X>Y>Z | |
| B. | Y、Z的气态氢化物中,前者更稳定 | |
| C. | Z、W的最高价氧化物对应水化物的酸性,前者更强 | |
| D. | X、W的气态氢化物相互反应,生成物中只含离子键不含共价键 |
13.下列反应中需要加入还原剂才能进行的是( )
| A. | H2→H2O | B. | Zn→Zn2+ | C. | Fe3+→Fe2+ | D. | CuO→CuCl2 |
11.NA代表阿伏加德罗常数的数值.下列有关NA的叙述中,正确的是( )
| A. | 1 mol 任何物质所含的分子数均为NA个 | |
| B. | 14 g氮气所含的N原子数为NA个 | |
| C. | 标准状况下,22.4 L水所含的H2O分子数为NA个 | |
| D. | 在钠与氯气的反应中,1 mol钠失去电子的数目为2 NA个 |