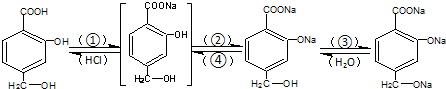
题目内容
6.SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可以写出Na2O•CaO•6SiO2.盛放NaOH溶液试剂瓶,若用玻璃纱容易造成瓶体与瓶塞黏连,而无法打开,发生反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O.长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同,由钠长石化学式NaAlSi3O8可推知钙长石的化学式为CaAl2Si2O8.分析 二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,硅酸钠的水溶液具有粘性;
根据不同类长石其氧原子的物质的量分数相同,结合化合价代数和是0可写出钙长石的化学式.
解答 解:玻璃中的二氧化硅与NaOH作用生成可用作粘合剂的硅酸钠溶液,反应的方程式为SiO2+2NaOH=Na2SiO3+H2O;由“长石是铝硅酸盐”,结合钠长石的化学式可知钙长石就是将钠长石的中钠更换为钙,铝硅酸阴离子不变,以及化合物中化合价代数和等于0可得钙长石的化学式为CaAl2Si2O8,
故答案为:SiO2+2NaOH=Na2SiO3+H2O;CaAl2Si2O8.
点评 本题考查了化学方程式的书写和化学式的确定,明确二氧化硅的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | CH4能使酸性KMnO4溶液褪色 | |
| B. | 金属Na能与C2H5OH中的甲基反应生成H2 | |
| C. | 乙酸有强烈的刺激性气味,其水溶液称为冰醋酸 | |
| D. | CH3CH2CH2CH3与CH3CH(CH3)2互为同分异构体 |
17.将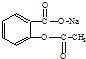 转变为
转变为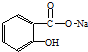 的方法正确的是( )
的方法正确的是( )
 转变为
转变为 的方法正确的是( )
的方法正确的是( )| A. | 与足量的NaOH溶液共热后,再通入足量的CO2 | |
| B. | 与稀H2SO4共热后,加入足量的Na2CO3 | |
| C. | 与足量的NaOH溶液共热后,加入足量的稀H2SO4 | |
| D. | 与稀H2SO4共热后,加入足量的NaOH |
14.有A,B,C,D四个反应:
则在任何温度下都能自发进行的反应是C;在任何温度下都不能自发进行的反应是B;另外两个反应中,在温度高于77℃时可自发进行的反应是A,在温度低于-161.6℃时可自发进行的反应是D.
| 反应 | A | B | C | D |
| △H/(kJ•mol-1) | 10.5 | 1.80 | -126 | -11.7 |
| △S/(J•mol-1•k-1) | 30.0 | -113.0 | 84.0 | -105.0 |
1.某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲灭火,却被实验老师及时制止,原因是CO2可以支持镁燃烧,发生反应:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,下列关于该反应的判断正确的是( )
| A. | Mg的化合价由0升高到+2,所以MgO是还原产物 | |
| B. | 由此反应可以判断氧化性CO2>MgO,还原性Mg>C | |
| C. | CO2作氧化剂,表现出氧化性,发生氧化反应 | |
| D. | Mg原子失去的电子数目等于氧原子得到的电子数目 |
11.在一定条件下,当生成8g SO3气体时,并放出热量9.83kJ.已知SO2在此条件边转化率为80%,据此,下列热化学方程式正确的是( )
| A. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98.3KJ•mol-1 | |
| B. | 2SO2(g)+O2(g)?2SO3(l);△H=-196.6KJ•mol-1 | |
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-78.64KJ•mol-1 | |
| D. | 2SO2(g)+O2(g)?2SO3(g);△H=+196.6KJ•mol-1 |