题目内容
4. MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )| A. | ROH是一种强碱 | B. | 在x点,MOH并没有完全电离 | ||
| C. | 在x点,c(M+)=c(R+) | D. | 稀释前,c(ROH)=10c(MOH) |
分析 由图可知,ROH开始的pH=13,稀释100倍pH=11,则ROH为强碱,而MOH开始的pH=12,稀释100倍pH=11,则MOH为弱碱,并根据酸碱中和及电离来解答.
解答 解:A.ROH开始的pH=13,稀释100倍pH=11,则ROH为强碱,故A正确;
B.由于MOH是弱碱,所以在x点,MOH没有完全电离,故B正确;
C.由ROH═R++OH-,MOH?M++OH-可知,在x点,c(OH-)相等,则c(M+)=c(R+),故C正确;
D.稀释前,c(ROH)=0.1mol/L,c(MOH)>0.01mol/L,则c(ROH)<10c(MOH),故D错误;
故选D.
点评 本题考查弱电解质的电离,明确图象中pH的变化及交点的意义是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
13.短周期元素A、B、C、D在周期表中的位置关系如图所示.已知在同周期元素的常见简单离子中,D的离子半径最小,E是周期表中半径最小的原子
回答下列问题:
(1)C元素在元素周期表中的位置是第二周期第VIA 族.元素D的离子结构示意图为
(2)B、E两元素按原子数目比1:3和2:4构成分子X和Y,X的电子式为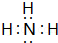 ,Y的结构式为
,Y的结构式为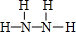 .
.
(3)A、B、C元素的氢化物均有两种或两种以上.在一定条件下A2E4与E2C可发生反应,化学方程式为CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH.
(4)工业上冶炼单质D的化学反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
(5)超细DB粉末被应用于大规模集成电路领域.其制作原理为D2C3、B2、A在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO.
| A | B | C | |
| D |
(1)C元素在元素周期表中的位置是第二周期第VIA 族.元素D的离子结构示意图为

(2)B、E两元素按原子数目比1:3和2:4构成分子X和Y,X的电子式为
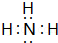 ,Y的结构式为
,Y的结构式为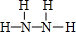 .
.(3)A、B、C元素的氢化物均有两种或两种以上.在一定条件下A2E4与E2C可发生反应,化学方程式为CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH.
(4)工业上冶炼单质D的化学反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
(5)超细DB粉末被应用于大规模集成电路领域.其制作原理为D2C3、B2、A在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO.
14.有A,B,C,D四个反应:
则在任何温度下都能自发进行的反应是C;在任何温度下都不能自发进行的反应是B;另外两个反应中,在温度高于77℃时可自发进行的反应是A,在温度低于-161.6℃时可自发进行的反应是D.
| 反应 | A | B | C | D |
| △H/(kJ•mol-1) | 10.5 | 1.80 | -126 | -11.7 |
| △S/(J•mol-1•k-1) | 30.0 | -113.0 | 84.0 | -105.0 |
11.在一定条件下,当生成8g SO3气体时,并放出热量9.83kJ.已知SO2在此条件边转化率为80%,据此,下列热化学方程式正确的是( )
| A. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98.3KJ•mol-1 | |
| B. | 2SO2(g)+O2(g)?2SO3(l);△H=-196.6KJ•mol-1 | |
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-78.64KJ•mol-1 | |
| D. | 2SO2(g)+O2(g)?2SO3(g);△H=+196.6KJ•mol-1 |
9.区别植物油和裂化汽油的正确方法是( )
| A. | 加酸性高锰酸溶液,振荡 | B. | 加NaOH溶液,煮沸 | ||
| C. | 加新制Cu(OH)2悬浊液,煮沸 | D. | 加溴水,振荡 |
13.下列反应中需要加入还原剂才能进行的是( )
| A. | H2→H2O | B. | Zn→Zn2+ | C. | Fe3+→Fe2+ | D. | CuO→CuCl2 |
14.如图所示的实验中,能达到实验目的是( )
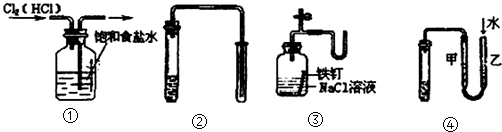
①除去Cl2中的HCl杂质②用铜和稀硝酸制取少量NO③证明铁生锈时空气参与反应④检验装置气密性.

①除去Cl2中的HCl杂质②用铜和稀硝酸制取少量NO③证明铁生锈时空气参与反应④检验装置气密性.
| A. | ①②③④ | B. | ③④ | C. | ②③④ | D. | ①④ |