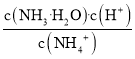题目内容
【题目】下列说法中正确的是( )
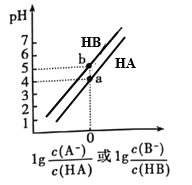
A.常温下,某溶液中由水电离出的![]() ,若
,若![]() ,则该溶液的
,则该溶液的![]()
B.常温下,某醋酸稀溶液![]() ,将此溶液稀释100倍后溶液的
,将此溶液稀释100倍后溶液的![]() ,则
,则![]()
C.等浓度的醋酸钠和盐酸按体积比2:1混合,则![]()
D.已知![]() 的
的![]() 为
为![]() ,则将等体积的
,则将等体积的![]() 的
的![]() 溶液和
溶液和![]() 溶液混合,会有
溶液混合,会有![]() 沉淀产生
沉淀产生
【答案】C
【解析】
A.水电离出的![]() ,若
,若![]() ,说明水的电离被抑制,该溶液为酸或碱溶液;
,说明水的电离被抑制,该溶液为酸或碱溶液;
B.醋酸为弱酸,稀释100倍后电离程度增大,溶液pH变化小于2个单位;
C.等浓度的醋酸钠和盐酸按体积比2:1混合,反应后溶质为醋酸钠、氯化钠和醋酸,结合电荷守恒、物料守恒分析;
D.计算溶液混合后的Qc,与Ksp比较大小后确定是否有沉淀生成。
![]() 某溶液中由水电离出的
某溶液中由水电离出的![]() ,若
,若![]() ,说明该溶液能抑制水的电离,可能是酸溶液或碱溶液,所以该溶液的pH值为a或
,说明该溶液能抑制水的电离,可能是酸溶液或碱溶液,所以该溶液的pH值为a或![]() ,故A错误;
,故A错误;
B.常温下,某醋酸稀溶液![]() ,将此溶液稀释100倍后,醋酸的电离程度增大,则稀释后溶液的pH变化小于2,溶液的
,将此溶液稀释100倍后,醋酸的电离程度增大,则稀释后溶液的pH变化小于2,溶液的![]() ,则
,则![]() ,故B错误;
,故B错误;
C.等浓度的醋酸钠和盐酸按体积比2:1混合,反应后溶质为![]() 、
、![]() 、NaCl,根据电荷守恒可得:
、NaCl,根据电荷守恒可得:![]() ,根据物料守恒可得:
,根据物料守恒可得:![]() ,结合
,结合![]() 可得:
可得:![]() ,故C正确;
,故C正确;
D.将等体积的![]() 的
的![]() 溶液和
溶液和![]() 溶液混合,Qc=(
溶液混合,Qc=(![]() ×10-4mol/L)2×
×10-4mol/L)2×![]() ×10-4mol/L=1.25×10-13<Ksp=1.12×10-12,说明溶液中不会生成
×10-4mol/L=1.25×10-13<Ksp=1.12×10-12,说明溶液中不会生成![]() 沉淀,故D错误;
沉淀,故D错误;
故选:C。

【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
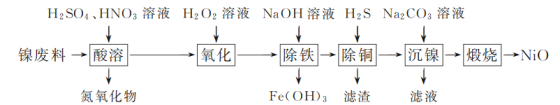
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。